Idiopathisches Parkinson-Syndrom
Neurologie
Steckbrief
Bei der Parkinson-Krankheit (PK), handelt es sich um die zweithäufigste neurodegenerative Erkrankung, die typischerweise im höheren Lebensalter auftritt. Ursächlich für die Symptomentwicklung sind ein Verlust vor allem dopaminerger Neurone sowie die Ablagerung von fehlgefaltetem α-Synuklein, welches sich in verschiedenen neuronalen Systemen ablagert und neurotoxisch wirkt. Die Genese der Erkrankung ist multifaktoriell: neben genetischer Prädisposition sind Umweltfaktoren sowie das steigende Lebensalter Kofaktoren, die eine Entstehung begünstigen. Es finden sich sowohl motorische (Rigor, Bradykinese, Tremor, posturale Instabilität) als auch nicht motorische Symptome (kognitive Einbußen, Depressionen, Schlafstörungen, autonome Dysregulation oder Schmerzen). Die Diagnose des IPS wird klinisch gestellt, apparative Zusatzuntersuchungen können die Diagnose nur unterstützen. Eine Behandlung erfolgt typischerweise mit Dopaminergika, in der späteren Krankheitsphase auch mittels Pumpentherapie oder der Tiefen Hirnstimulation.
Synonyme
- Morbus Parkinson
- idiopathisches Parkinson-Syndrom
- Parkinson-Krankheit
- Parkinson’s disease
- Parkinson-Syndrom
- Lewy-Körperchen-Erkrankung
- Lewy body disease
- Synukleinopathie
Keywords
- Morbus Parkinson
- idiopathisches Parkinson-Syndrom
- Parkinson-Krankheit
- Parkinson’s disease
- Parkinson-Syndrom
- Dopamin
- Tiefe Hirnstimulation
- Bewegungsstörung
- Apomorphin
- Pumpentherapie
Definition
- Die klinische Definition der PK umfasst die motorischen Hauptsymptome Rigor, Tremor, Akinese sowie nicht-motorische Symptomen, die kognitive, emotionale und autonome Dimensionen umfassen.
- Die Prodromalphase kann z.B. eine REM-Schlaf-Verhaltensstörung, eine subtile Parkinson-Symptomatik oder eine Anosmie umfassen.
- In der späten Krankheitsphase ist die Entwicklung einer Parkinson-Demenz möglich.
Epidemiologie
Häufigkeit
- Die PK ist, nach der Alzheimer-Krankheit, die zweithäufigste neurodegenerative Erkrankung.
- Es handelt sich um eine Erkrankung mit steigender Prävalenz in höherem Lebensalter. Diese liegt zwischen 100 und 200/100000 Einwohner (0,1–0,3%).
- Die Prävalenzraten sind altersabhängig: In Deutschland liegt sie im Alter von 70–74 Jahren bei 700/100000 Einwohner und zwischen 75 und 79 Jahren bei 1800/100000 Einwohner.
Altersgipfel
-
Das Durchschnittsalter bei Erkrankungsbeginn liegt bei ca. 60 Jahren. Bei weniger als 5% der Erkrankten beginnt die Erkrankung vor dem 50. Lebensjahr.
Geschlechtsverteilung
-
Männer sind 1,5–2-fach häufiger betroffen als Frauen
Prädisponierende Faktoren
Für die PK wurden rezent sowohl Risikofaktoren als auch Prodromalsymptome etabliert. Zu den Risikofaktoren zählen (in absteigender Reihenfolge):
- bekannte Genmutation
- Geschwister mit „young onset“ IPS
- hyperechogene Substantia nigra
- Verwandter 1. Grades (keine Geschwister) mit PK
- berufliche Lösungsmittelexposition
- regelmäßige Pestizidexposition
- Koffeinabstinenz
- lebenslanger Nichtraucher
- männliches Geschlecht
Ätiologie und Pathogenese
- Die PK wird verstanden als ein neurodegeneratives Syndrom, welches motorische und nicht motorische neuronale Schaltkreise betrifft.
- Grundlegend sind zwei verschiedene pathologische Prozesse involviert:
- frühzeitiger selektiver Verlust dopaminerger Neurone, vor allem in der Substantia nigra
- Akkumulation von fehlgefaltetem α-Synuklein, welches sich in verschiedenen neuronalen Systemen aggregiert und u.a. neurotoxisch wirkt. Auch kleinste α-Synuklein-Fragmente können bereits neurotoxisch wirken. Diese Fragmente werden u.a. von Neuronen freigesetzt und von Nachbarneuronen aufgenommen; hierdurch werden die neurotoxischen Elemente in einer prionartigen Ausbreitung im Gehirn verbreitet. Teils zusätzlich finden sich noch Lewy-Körperchen, die größtenteils aus aggregiertem α-Synuklein bestehen und vor allem für die Entwicklung nicht motorischer Symptome (kognitive Funktionseinbußen, Angststörung oder orthostatische Hypotension) verantwortlich sind.
- Im Krankheitsverlauf kommt es zu einer schrittweisen Zunahme der Neurodegeneration – bei Auftreten von motorischen Symptomen sind bereits 30–70% der dopaminergen Zellen in der Substantia nigra untergegangen.
- Neben dem Untergang von dopaminergen Neuronen ist die Bedeutung des serotonergen, noradrenergen, cholinergen, teils auch peripheren Nervensystems, für die Entwicklung von kognitiven Einschränkungen, Impulskontrollstörungen, Depression oder autonomer Dysfunktion zunehmend erkannt worden.
- Die PK wird als multifaktorielle Erkrankung angesehen. Es spielen hierbei eine genetische Suszeptibilität als auch Lebens- und Umweltfaktoren in einem alternden Gehirn eine Rolle. Als typische Risikofaktoren wurden männliches Geschlecht, Lösungsmittel- und Pestizidexposition sowie Nikotin- und Koffeinabstinenz angesehen (s. Kap. Prädisponierende Faktoren).
- Etwa 5% der Parkinson-Syndrome gehen auf monogenetische Ursachen zurück. Insbesondere bei jungem Erkrankungsalter sollte eine monogenetische Ursache in Erwägung gezogen werden. In den vergangenen 2 Jahrzehnten sind hierfür 6 Gene identifiziert worden, die im Wesentlichen der PK ähnliche Erkrankungsbilder auslösen (PARK-SNCA, PARK-LRRK2, PARK-VPS35, PARK-Parkin, PARK-PINK1, PARK-DJ-1).
Klassifikation und Risikostratifizierung
- Für die PK ist die Stadieneinteilung nach Hoehn und Yahr (Tab. 20.1) etabliert. Diese wird nach dem Zustand im medikamentösen Off beurteilt und umfasst eine Skalierung von I–V.
- Eine Einteilung nach dem Erkrankungsalter spiegelt sich wider im juvenilen (Erkrankungsalter <21 Jahre), „early-onset“ (21–50 Jahre) und „late-onset“ IPS (>60 Jahre).
- Es wird häufig zwischen Prodromalphase, früher Krankheitsphase (1.–5. Krankheitsjahr), fortgeschrittener Krankheitsphase (Beginn von Wirkfluktuationen, ab dem 5. Krankheitsjahr) und später Krankheitsphase (Auftreten von Halluzinationen, Stürzen, Demenz) unterschieden.
- Die United Parkinson’s Disease Rating Scale (UPDRS) ermöglicht eine Graduierung des Schweregrads in 4 verschiedenen Symptomdimensionen (Kognition, Alltagsaktivitäten, Motorik und Komplikationen). Eine weiterentwickelte Version (MDS-UPDRS) versucht, Schwächen (z.B. fehlende Berücksichtigung nicht motorischer Symptome oder geringer Symptomausprägung) zu vermeiden.
- Für die Schweregradeinstufung nicht motorischer Symptome steht z.B. die Parkinson’s Disease Non-motor-Scale (PD-NMS) zur Verfügung.
- Für das IPS wurden immer wieder verschiedene Subtypen diskutiert. Aktuell herrscht Konsens, dass es sich um ein sehr heterogenes Erkrankungsbild handelt. Definitive Subtypen, wie in der Vergangenheit vorgeschlagen, sind jedoch nicht (mehr) etabliert. Die aus Datenanalysen robusteste Subgruppe (nur 10–25% der Patienten) zeigt ein breites Spektrum nicht motorischer Symptome (z.B. „mild cognitive impairment“ [MCI], REM-Schlaf-Verhaltensstörung, Dysautonomie), frühe ausgeprägte motorische Einschränkungen und einen rascheren Verlauf.
Symptomatik
- Die Symptome des IPS können in motorische und nicht motorische Symptome unterteilt werden und ändern sich im Krankheitsverlauf.
- Kardinalsymptome sind der Parkinsonismus mit
- Rigor
- Tremor
- Akinese
- posturale Instabilität
- Typische Symptome der frühen Krankheitsphase:
- motorisch
- Schwierigkeiten beim Drehen im Bett
- „frozen shoulder“
- Steifigkeit
- Hypophonie
- reduzierter Armschwung
- Mikrografie
- feinmotorische Störungen
- nicht motorisch
- Obstipation
- REM-Schlaf-Verhaltensstörung
- Anosmie
- Depression, Angst, Apathie
- erektile Dysfunktion
- Schmerzen
- motorisch
- Typische Symptome der fortgeschrittenen Krankheitsphase:
- motorisch
- motorische Fluktuationen
- Dyskinesien
- „freezing of gait“
- Stürze
- nicht motorisch
- nicht motorische Fluktuationen (u.a. Inkontinenz, Stimmung, Konzentration)
- Dysphagie
- autonome Störungen (Schwitzen, orthostatische Hypotension, Speichelfluss, Blasendysfunktion)
- kognitive Funktionsstörungen (MCI, Demenz)
- Halluzinationen
- Impulskontrollstörungen
- motorisch
- Die Bradykinese (auch Akinese oder Hypokinese) ist eine allgemeine Bewegungsverlangsamung, aber auch Störung der Bewegungsinitiierung oder Bewegungsamplitude. Deutlich wird dies schon früh in einer Mikrografie, aber auch durch feinmotorischen Handlingproblemen oder eine Gangstörung mit reduziertem Armschwung.
- Auch die Hypomimie oder Hypophonie zählen zu dem Symptomspektrum. Ein einseitiger Beginn ist hierfür typisch.
- Der Rigor ist eine Tonuserhöhung, unabhängig vom Bewegungsumfang oder der Geschwindigkeit, und führt zu einer Versteifung der Bewegung, einer Haltungsstörung mit vornübergebeugtem Oberkörper und v.a. auch Schmerzen. Das Gangbild wird durch eine Kombination dieser Symptome kleinschrittig und schmalbasig.
- Die posturale Instabilität kann Stürze begünstigen, ebenso wie das „freezing of gait“ (Einfrieren des Gangs mit Starthemmung/motorischer Blockade).
- Der Parkinson-Tremor ist durch einen einseitig betonten Ruhetremor v.a. der Hände oder Beine charakterisiert. Seltener kann auch ein Halte- oder Aktionstremor auftreten.
- Zusätzlich werden Parkinson-MCI und Parkinson-Demenz unterschieden, die typischerweise mit Einschränkungen der Exekutivfunktionen, der Wortflüssigkeit, der Visuokonstruktion und des Arbeitsgedächtnisses einhergehen. Klinisch führt dies vor allem zu einer Denkverlangsamung, reduzierter Anpassung an neue Situationen oder Perseverationen. Anders als in der Vergangenheit sollte heute das frühe Auftreten einer Demenz nicht mehr als Lewy-Körperchen-Erkrankung, sondern als Parkinson-Demenz gewertet werden.
- Als mögliche Vorstufe des IPS werden in der sogenannten Prodromalphase folgende Faktoren angesehen:
- REM-Schlaf-Verhaltensstörung
- pathologischer dopaminerger PET/SPECT-Befund
- mögliche subtile Parkinson-Symptomatik
- pathologische quantitative motorische Testung
- Anosmie
- Obstipation
- exzessive Tagesmüdigkeit
- symptomatische Hypotension
- schwere erektile Dysfunktion
- Blasenentleerungsstörung
- Harninkontinenz
- Depression/Angststörung
Diagnostik
Diagnostisches Vorgehen
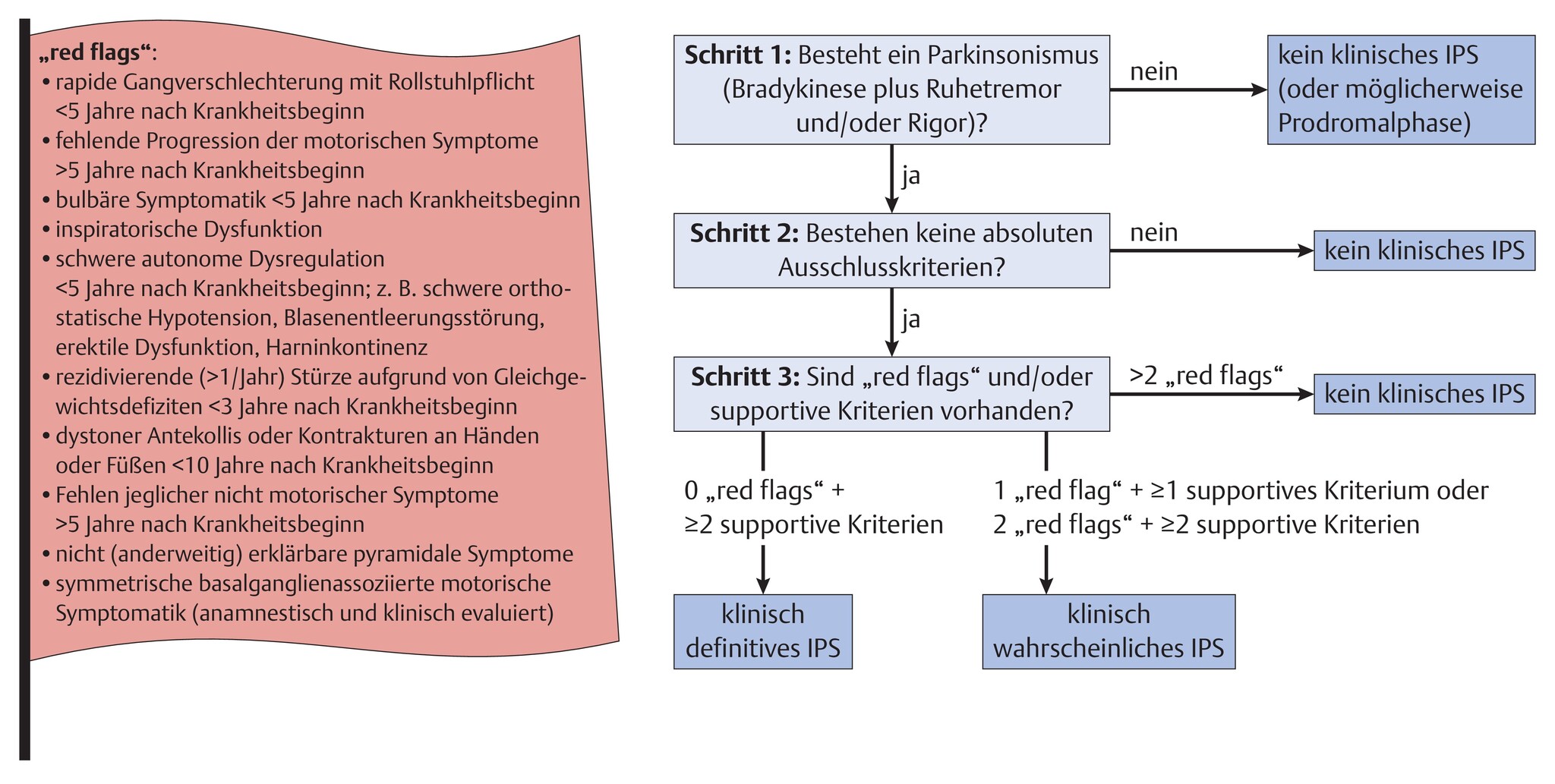
- Die Diagnose einer PK wird klinisch gestellt. Die Grundlage ist nach wie vor das Vorhandensein eines Parkinsonismus (Bradykinese und/oder Ruhetremor, Rigor).
- Wenn keine Ausschlusskriterien vorhanden sind, können „red flags“ oder supportive Kriterien die Diagnosewahrscheinlichkeit erhöhen, sodass die Unterscheidung zwischen einem klinisch sicheren oder klinisch wahrscheinlichem IPS getroffen werden kann (Abb. 20.1):
- Ausschlusskriterien
- zerebelläre Zeichen
- vertikale Blickparese (nach unten gerichtet)
- Diagnose einer möglichen frontotemporalen Demenz oder primär progressiven Aphasie <5 Jahre nach Krankheitsbeginn
- streng beinbetonte basalganglienassoziierte motorische Symptomatik >3 Jahre
- Medikation mit Dopaminblocker oder dopaminabbauenden Substanzen
- fehlendes Ansprechen auf hochdosierte Levodopa-Therapie (>600mg/d)
- Verlust kortikaler Sensibilität (z.B. Graphästhesie, Stereognosie), deutliche ideomotorische Apraxie oder progressive Aphasie
- normaler DaTSCAN-Befund
- dokumentierte Erkrankung, die ein Parkinson-Syndrom auslösen kann und im Zusammenhang mit der Symptomatik des Patienten steht
- supportive Kriterien
- deutliches Ansprechen auf dopaminerge Therapie
- Levodopa-induzierte Dyskinesien
- Ruhetremor einer Extremität
- Anosmie oder kardiale sympathische Denervierung in der MIBG-Szintigrafie (MIBG: Metaiodbenzylguanidin)
- Ausschlusskriterien
- Es werden insbesondere auch nicht motorische Symptome stärker für die Definition der Prodromalphase berücksichtigt, z.B. REM-Schlaf-Verhaltensstörung, Anosmie, Depression, Obstipation, exzessive Tagesmüdigkeit oder Blasenentleerungsstörungen.
- Das Vorliegen einer Demenz ist aktuell kein Ausschlusskriterium mehr. Somit ist die Demenz mit Lewy-Körperchen (DLB) in der aktuellen Definition als ein Parkinson-Subtyp klassifiziert, sobald alle anderen Kriterien für eine PK erfüllt sind.
Abb. 20.1 Diagnosekriterien der Parkinson-Krankheit (PK).
Anamnese
- Die Patienten berichten vor Diagnosestellung typischerweise von
- Einschränkungen der Feinmotorik
- Gangstörungen
- einer Hypomimie
- Schmerzen im Bereich des Nackens/der Schulter
- oft zusätzlich angegeben werden
- Rückzugstendenzen
- depressive Verstimmung
- Konzentrations- oder Schlafstörungen
Körperliche Untersuchung
- motorische Untersuchung:
- Die Bradykinese, welche durch eine Verlangsamung der Bewegung gekennzeichnet ist, wird untersucht durch die Diadochokinese, eine Amplituden- und Frequenzreduktion des Fingertappings (vor allem im Seitenvergleich) oder einen reduzierten Armschwung.
- Das Gangbild wird durch Kleinschrittigkeit und erhöhte Wendeschrittzahl dominiert.
- Der Rigor wird bei freier Bewegung von Nacken, Armen und Beinen untersucht. Einen rigorartig erhöhten Tonus findet man insbesondere bei Koaktivierung der Gegenseite (Froment-Manöver).
- Die posturale Stabilität wird im Pull-Test (ruckartiges nach hinten Ziehen des Patienten, Überprüfung der Stellreflexe) überprüft.
- Der Tremor ist durch einen niedrigfrequenten Ruhetremor (4–5Hz), einseitig betont, gekennzeichnet. Auftreten kann zusätzlich ein Haltetremor, der nach einigen Sekunden Haltearbeit auftritt (sogenannter „re-emergent tremor“). Seltener sind ein reiner Halte- oder Aktionstremor.
- Die nicht motorischen Symptome werden typischerweise durch die Anamnese, spezifische Fragebögen oder neuropsychologische Diagnostik erfasst. Sinnvoll kann noch ein Riechtest (z.B. mit Sniffin Sticks) sein.
- Eine orthostatische Hypotension kann z.B. durch den Schellong-Test erfasst werden.
- Levodopa-/Apomorphin-Test :
- Durch die Gabe von Levodopa (100mg + 25mg Carbidopa/Benserazid) kann das Ansprechen auf Levodopa überprüft werden. Eine Verbesserung von 30% (gemessen am Skalenwert des UPDRS III) wird als klinisch relevant angesehen.
- Auch die Gabe von Apomorphin subkutan (2–3mg, ggf. mit sukzessiver Steigerung um 2mg, obligatorische Vorbehandlung mit Domperidon 3-mal 10mg) kann zur Testung der Verbesserung der motorischen Funktionen herangezogen werden.
Labor
-
Der Ausschluss einer symptomatischen Enzephalopathie sollte mittels eines Routinelabors (Blutbild, Nierenretentionsparameter, Leberwerte, Schilddrüsenhormone, Vitamin B12, Elektrolyte) erfolgen.
-
Eine regelhafte molekulargenetische Testung hat derzeit (noch) keine therapierelevante Bedeutung und sollte z.B. bei familiärer Häufung in Betracht gezogen werden.
Neuropsychologische Testung
- Die Diagnose einer Parkinson-MCI wird ermöglicht, wenn Patienten oder Angehörige eine zunehmende kognitive Verschlechterung angeben, die nicht ihre Unabhängigkeit beeinträchtigt. Ein allgemeiner Test zur Erfassung der kognitiven Leistung bei IPS muss für die Diagnosestellung eingeschränkt sein (u.a. Montreal Cognitive Assessment [MoCA], Scales for Outcomes of Parkinson’s Disease Cognition [SCOPA-COG], Mattis Dementia Rating Scale, Parkinson Neuropsychometric Dementia Assessment [PANDA]; nicht empfehlenswert sind Demenz Detection Test [DemTect] oder Mini Mental Status Test [MMSE]); alternativ müssen Einschränkungen in mindestens zwei neuropsychologischen Domänen (Aufmerksamkeit, Sprache, Visuokonstruktion, Gedächtnis, Exekutivfunktionen) objektiviert werden.
- Für die Diagnose einer Parkinson-Demenz müssen zusätzlich relevante Einschränkungen in Alltagsaktivitäten vorliegen.
- Weitere symptomspezifische Fragebögen ermöglichen das Screening oder auch die Diagnostik von spezifischen neuropsychologischen/-psychiatrischen Fragestellungen. Hierbei ist zu berücksichtigen, dass die meisten der Untersuchungsinstrumente nicht für das IPS validiert sind. Beispiele hierfür sind: AES (Apathie Evaluations Skala), BDI (Beck Depressions Inventar), BIS (Barrett Impulsiveness Scale).
Bildgebende Diagnostik
- Die bildgebende Diagnostik ermöglicht anhand der strukturellen Bildgebung des Schädels (cCT/cMRT) eine Ausschlussdiagnostik. Die funktionelle (nuklearmedizinische) Diagnostik ist im Einzelfall für die Differenzialdiagnose des IPS hilfreich, jedoch nicht zwingend für die Diagnosestellung erforderlich.
Sonografie
-
Die Darstellung der Hyperechogenität der Substantia nigra kann zusatzdiagnostisch zur Unterscheidung zwischen IPS-Patienten und Gesunden herangezogen werden.
MRT
-
Eine Nativbildgebung des Schädels ermöglicht den Ausschluss von relevanten Differenzialdiagnosen bzw. symptomatischen Ursachen (z.B. Normaldruckhydrozephalus, subkortikale arteriosklerotische Enzephalopathie, strategische Infarkte der Basalganglien, Raumforderungen des Hirnstamms). In der Routinediagnostik ist der cMRT gegenüber die Computertomografie aufgrund der besseren Beurteilbarkeit von insbesondere auch vaskulären Läsionen der Vorzug zu geben.
-
Die Differenzialdiagnostik zwischen dem IPS und der Multisystematrophie/progressiven supranukleären Blickparese (MSA bzw. PSP) ist u.a. möglich durch die Darstellung eines hyperintensen putaminergen Randsaums (MSA), einer striatalen Atrophie (MSA), dem „hot-cross bun sign“ (MSA) oder einer Atrophie des Mesenzephalons (Kolibri-Zeichen; PSP). Der Parkinson-Index (Verhältnis der Fläche Pons/Mittelhirn) ermöglicht eine zuverlässige Unterscheidung zwischen IPS und PSP.
Szintigrafie
- Die Bildgebung des dopaminergen Systems kann mittels eines FP-CIT-SPECT (DaTSCAN; FP-CIT: 123I-N-ω-fluoropropyl-2β-carbomethoxy-3β-(4-iodophenyl)nortropane) erfolgen. Hiermit wird eine zuverlässige Unterscheidung zwischen Parkinson-Syndromen und anderen Ursachen ermöglicht (vor allem essenzieller Tremor). Eine Differenzierung in unterschiedliche Parkinson-Syndrome ist anhand des FP-CIT-SPECT nicht möglich.
- Indikation für ein FP-CIT-SPECT können sein:
- fehlendes Ansprechen auf Levodopa
- Differenzialdiagnose des Tremors
- mangelnde Krankheitsakzeptanz
- Die MIBG-SPECT kann durch eine Bindung an postganglionäre sympathische Efferenzen die kardiale sympathische Innervation darstellen. Diese ist beim IPS reduziert, bei z.B. der MSA hingegen jedoch normwertig.
- Die Befundgenauigkeit des IBZM-SPECT (IBZM: 123I-Jodbenzamid) ist aufgrund reduzierter Sensitivität/Spezifität begrenzt und somit in der Routinediagnostik nicht empfehlenswert.
PET/PET-CT
-
Bildgebung des zerebralen Glukosestoffwechsels mittels 18F-FDG-PET (FDG: Fluordesoxyglucose) erlaubt eine korrekte Unterscheidung zwischen dem IPS und atypischen Parkinson-Syndromen (MSA, PSP und kortikobasale Degeneration [CBD]) aufgrund spezifischer kortikaler und subkortikaler Bindungsmuster.
Differenzialdiagnosen
Die Differenzialdiagnosen sind in Tab. 20.2 dargestellt.
|
essenzieller Tremor |
Der Parkinson-Tremor ist ein Ruhetremor, beim essenziellen Tremor handelt es sich um einen annähernd seitensymmetrischen Halte- und Aktionstremor ohne weitere neurologische Symptome. Differenziert werden kann dies zusätzlich noch durch ein fehlendes Ansprechen im Levodopa-Test, positive Familienanamnese und Alkoholresponsivität sowie ggf. einen DAT-Scan. |
|
klinische Differenzierung durch Hakim-Trias (demenzielle Entwicklung, Harninkontinenz, Gangstörung) mit vor allem breitbasig-haftendem Gangbild, differenzialdiagnostisch unterscheidbar durch cCT und Liquorablass |
|
|
vaskuläres Parkinson-Syndrom |
bei Auftreten von strategischen Infarkten plötzliches Einsetzen der Symptomatik, bei SAE vor allem höheres Lebensalter, stärkere Gangstörung, frühe Demenz, Pyramidenbahnzeichen, Inkontinenz; Levodopa hilft meist weniger; in der MRT diffuse Läsionen der Weißen Substanz als Zeichen der SAE |
|
symmetrisches Auftreten einer akinetisch-rigiden Symptomatik nach Gabe von z.B. Dopaminrezeptorantagonisten (Neuroleptika); reversibel nach Absetzen der Medikation; FP-CIT-SPECT meist unauffällig; nicht motorische Symptome sind untypisch |
|
|
Multisystematrophie (MSA) |
frühes Auftreten relevanter autonomer Dysfunktion (Inkontinenz, orthostatische Hypotension), rasches Fortschreiten der Symptome, ggf. führend zerebelläre Zeichen (MSA-C), frühe Stürze/auf Rollstuhl angewiesen; wenig Ansprechen auf Levodopa; typische MRT- und FDG-PET-Veränderungen |
|
progressive supranukleäre Blicklähmung (PSP) |
frühes Auftreten von Stürzen, Blickparese, kognitiven Einschränkungen; reduziertes Ansprechen auf Levodopa; typische MRT-Veränderungen |
|
einseitige Betonung von Apraxie, Alien-limb-Phänomen, Rigor, Bradykinese; wenig Ansprechen auf Levodopa; kortikale Atrophie im MRT, reduzierter Stoffwechsel kortikal im FDG-PET |
|
|
selten nach schweren Schädel-Hirn-Traumata mit oder ohne Mittelhirneinklemmung |
|
|
Vor allem das Auftreten im jüngeren Lebensalter sowie psychische Auffälligkeiten, eine Ataxie und ein Tremor sind neben einem akinetisch-rigiden Parkinsonismus typisch. Es findet sich fast obligat ein Kayser-Fleischer-Kornealring. Wegweisend sind die Laboruntersuchungen des Kupferstoffwechsels. |
|
|
cCT: kraniale Computertomografie, FDG-PET: Fluordesoxyglucose-Positronenemissionstomografie, FP-CIT-SPECT: 123I-N-ω-fluoropropyl-2β-carbomethoxy-3β-(4-iodophenyl)nortropane-Einzelphotonen-Emissionscomputertomografie, MRT: Magnetresonanztomografie, SAE: subkortikale arteriosklerotische Enzephalopathie |
|
Therapie
Therapeutisches Vorgehen
- Grundlegender Leitgedanke der Therapie der PK ist eine ausreichende Linderung der Symptome, die Vermeidung von Nebenwirkungen und damit eine möglichst gute Lebensqualität der Patienten.
- Direkt bei Diagnosestellung einer PK sollte eine medikamentöse Therapie begonnen werden. Ziel dieser Therapie – gerade in den ersten Monaten und Jahren – ist die Funktionsfähigkeit im Alltag und die Kupierung von nicht motorischen und motorischen Symptomen.
- Zum momentanen Zeitpunkt ist noch keine krankheitsmodifizierende Therapie bei der PK bekannt.
- Begleitet wird die medikamentöse Therapie von Anfang an durch ein intensives Programm von Eigenübungen und ggf. auch Physiotherapie. Hier ist besonderer Schwerpunkt auf Beweglichkeit, Ausdauer und Behandlung von spezifischen Problemen wie dem „freezing of gait“ zu legen.
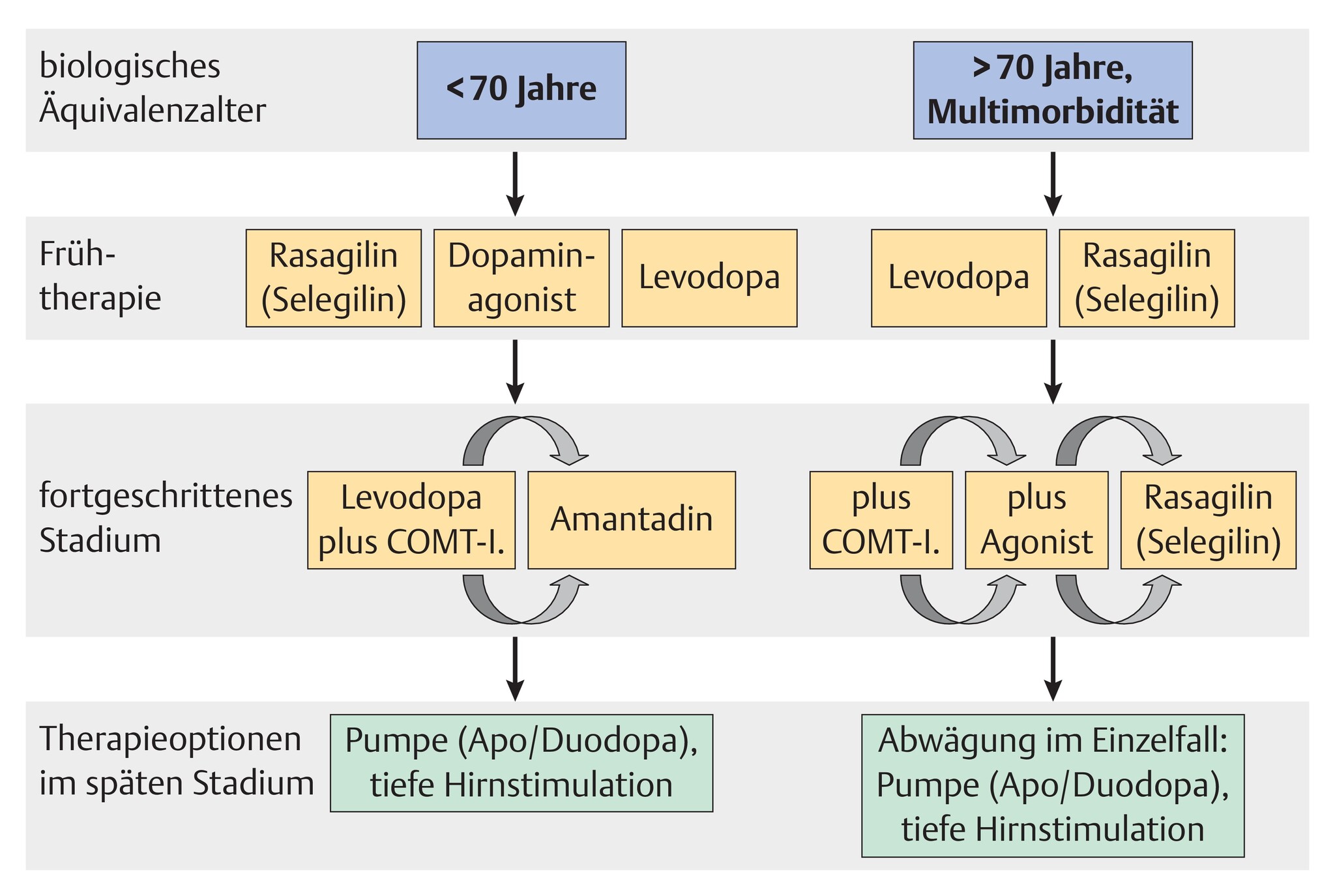
- Sobald keine ausreichende Linderung der Symptome durch eine medikamentöse Therapie mit ergänzenden Verfahren zu erzielen ist, ist eine Therapieeskalation sinnvoll. Als grundsätzliche Therapieverfahren stehen hier die Pumpentherapien mit Apomorphin, einem Dopaminagonisten, eine Levodopa-Infusionstherapie und die Tiefe Hirnstimulation zur Verfügung. Die grundsätzliche Therapiestrategie gemäß der Deutschen Leitlinien ist in Abb. 20.2 dargestellt.
Abb. 20.2 Therapiestrategie bei der PK gemäß den DGN-Leitlinien; COMT-I.: Catechol-O-Methyltransferase-Inhibitoren. (Daten aus: Eggert KM, Oertel WH, Reichmann H. Parkinson-Syndrome – Diagnostik und Therapie. Deutsche Gesellschaft für Neurologie. 2012)
Allgemeine Maßnahmen
Physiotherapie
- Schon zu Beginn der Parkinsonerkrankung ist eine Physiotherapie unter Anleitung sinnvoll. In den ersten Jahren kann diese bei geringer Behinderung im Wesentlichen vom Patienten alleine oder in einer Gruppentherapie durchgeführt werden.
- Etabliert hat sich als effektive Physiotherapie das Lee-Silverman-Voice-Treatment BIG-Training: Hier werden großamplitudige Bewegungen durchgeführt, die der Tendenz zu kleinen Bewegungen entgegenstehen.
- Gerade bei Problemen wie dem „freezing of gait“ ist ein gezieltes Training durch das Erlernen von Schlüsselreizen (Cueing-Verfahren) außerordentlich sinnvoll.
- Die posturale Instabilität kann durch Verfahren wie Tai-Chi deutlich verbessert werden, daneben können begleitende Therapie wie Tanzen, Reiten, Musiktherapie oder andere ergänzende Therapien für Patienten sinnvoll sein.
- In der Praxis ist eine Verschreibung von einer Physiotherapiestunde pro Woche in Anfangsstadien mit einer Steigerung auf 2h Physiotherapie pro Woche bei vielen Patienten ein sinnvolles Maß. Darüber hinaus sollte ein tägliches Eigenprogramm und/oder Übungen in der Gruppe initiiert werden.
Diätetische Maßnahmen
- Die Reduktion von Levodopa ist durch die Einnahme von Proteinen deutlich reduziert. Deswegen ist ein Abstand von mindestens 0,5–1h vor einer Mahlzeit und ca. 2h nach einer Mahlzeit zur besseren Aufnahme von Levodopa sinnvoll.
- Eine Reihe von unterschiedlichen diätetischen Maßnahmen wurde in den letzten Jahren diskutiert. Die Evidenz ist hier noch unvollständig, sodass keine allgemeingültigen Empfehlungen abgegeben werden können. Erfolgreich für viele Patienten erscheint jedoch eine ausreichende Flüssigkeitszufuhr, die reichliche Aufnahme von Ballaststoffen und eine abwechslungsreiche leichte Kost.
Logopädie
- Eine Sprach- und Sprechstörung bei Patienten mit IPS ist durch eine leise Stimme (Hypophonie), eine undeutliche Stimme (Dysarthrie) und durch spezifische Sprechstörungen, wie die „speech hesitation“ (Sprechhemmung ähnlich dem Stottern) gekennzeichnet.
- Hier ist eine große Wirksamkeit von Logopädie, insbesondere der Lee-Silverman-Voice-Treatment LOUD (LSVT) gezeigt worden. Diese Therapie erlaubt es dem Patienten, laut und damit auch deutlich zu sprechen. Indirekte Effekte im Sinne einer Verbesserung der Schluckstörung, der Mimik und der Lebensqualität konnten gezeigt werden.
- Die LSVT Loud-Therapie sollte mit 4 Stunden à 60min pro Woche über einen Zeitraum von 4 Wochen verschrieben werden. Eine nachfolgende Beübung zum Erhalt der Fähigkeiten hat sich in der Praxis bewährt.
Pharmakotherapie
- Die Pharmakotherapie sollte mit Diagnosestellung beginnen.
- Durch den Beginn der Pharmakotherapie ist sowohl die Sterblichkeit des Patienten als auch seine langfristige Behinderung positiv zu beeinflussen. Ein Hinweis auf eine Krankheitsmodifikation im Sinne einer Neuroprotektion konnte bislang für kein Präparat erbracht werden.
- Die Pharmakotherapie beim IPS ist unterschiedlich für jüngere Patienten (unter 70 Jahre) und Patienten im höheren Lebensalter (über 70 Jahre) oder mit Multimorbidität.
- Spezifische Probleme, wie der Parkinson-Ruhetremor, erfordern eine besondere Therapie.
- Grundsätzlich sollte bei Beginn der Therapie berücksichtigt werden wie schwer der Patient betroffen ist und wie seine Gesamtsituation ist.
- Gründe für eine frühe Therapieeinleitung mit Levodopa könnten sein:
- relevante Behinderung im Alltag und damit Verlust der sozialen Funktionsfähigkeit
- eine begleitende demenzielle Entwicklung mit dem Risiko von Halluzinationen oder anderen Problemen unter Dopaminagonisten
- Unverträglichkeiten von Dopaminagonisten in der Vergangenheit
- Gründe für eine Therapieeinleitung mit einem Dopaminagonisten:
- mittelgradige bis mäßige Beeinträchtigung durch die Parkinson-Erkrankung
- Notwendigkeiten im Alltag für eine einmalige Einnahme eines Medikaments oder einer transdermalen Applikation
- weitere Begleitsymptome, welche möglicherweise durch einen Dopaminagonisten positiv beeinflusst werden können, z.B. depressive Störung
- In einzelnen Fällen Therapieeinleitung z.B. mit einem MAO-B-Hemmer (MAO: Monoaminooxidase) oder z.B. Amantadin.
Dopaminagonisten
- Die meisten Patienten unter 70 Jahre beginnen die Pharmakotherapie mit einem Dopaminagonisten.
- Grund ist die Vermeidung von späteren Dyskinesien und die häufig einfachere Applikationsform.
- Spezifische Dopaminagonisten scheinen ein im klinischen Alltag unterschiedliches Profil aufzuweisen. So ist nach Erfahrung der Autoren eine nicht motorische Störung wie Obstipation unter der Gabe von Rotigotin als transdermales Pflaster besser zu kupieren als mit oraler Therapie. Dagegen sind Knöchelödeme und Aufmerksamkeitsstörungen oftmals seltener zu finden unter der Gabe von Piribedil. Die vermutlich beste Wirkung gegen eine begleitende depressive Symptomatik, aber auch das höchste Maß an Impulskontrollstörungen ist unter der Eindosierung von Pramipexol zu finden.
- Die üblichen Nebenwirkungen von Dopaminagonisten sind neben Übelkeit, Schwindel und anderen gastrointestinalen Symptomen, gerade bei Non-Ergot-Dopaminagonisten, Müdigkeit, Knöchelödeme und insbesondere Impulskontrollstörungen. Diese umfassen, in unterschiedlicher Ausprägung, Symptome wie Spielsucht, Hypersexualität, Schweißattacken, Kaufsucht oder andere Süchte wie z.B. Internetsucht. Über die Nebenwirkungen wie Impulskontrollstörungen muss wegen der teils verheerenden sozialen Konsequenzen von Neurologen aufgeklärt werden.
- Die Dosierung zu Beginn der Therapie sollte möglichst niedrig sein. Bewährt haben sich initiale Dosierungen von z.B. Piribedil mit 50mg abends, Pramipexol mit 3-mal 0,18mg, Ropinirol retard mit 2mg morgens oder Rotigotin als transdermales Pflaster mit 2mg/24h.
- Eine übliche Steigerung umfasst in der Regel die Höhe der Anfangsdosis pro Woche. Grundlegendes Prinzip der weiteren Steigerung ist das Auftreten von Nebenwirkungen oder das Erreichen einer guten Beweglichkeit.
- Im Verlauf der Erkrankung sollte mindestens 2-mal im Jahr die aktuelle Beweglichkeit und die Medikation überprüft und ggf. angepasst werden.
- In einzelnen Fällen können Kombinationen von Dopaminagonisten durchaus sinnvoll sein. Hinzuweisen ist hier, dass es sich um einen Off-Label-Gebrauch handelt.
- eine neue Applikationsform besteht in der sublingualen Apomorphin-Gabe zur Behandlung von unvorhersehbaren Off-Zuständen. Ein Blattfilm wird unter die Haut gelegt und führt innerhalb von 15-30 Minuten zu einem Rückgang der Off-Symptomatik. Nebenwirkungen sind vor allem lokal in Form von Schleimhautschwellungen oder Ulzerationen zu erwarten.
Levodopa
- Grundlage der Pharmakotherapie des IPS ist die Gabe von Levodopa, es hat die höchste Effektivität bei geringsten Nebenwirkungen. Mögliche Nebenwirkungen sind Übelkeit, Erbrechen, aber auch eine euphorisierende Wirkung.
- Die Einstiegsdosierung beträgt 3-mal 50mg, sie sollte vorsichtig gesteigert werden nach klinischer Notwendigkeit.
- Levodopa zeigt bei langfristiger Applikation die Tendenz, Dyskinesien wahrscheinlicher zu machen. Eine Schwellendosis zum langfristigen Auslösen von Dyskinesien unter Levodopa-Therapie ist nach Studienlage und Erfahrung der Autoren bei etwa 4mg/kg Körpergewicht anzusetzen. Höhere Dosierungen sind jedoch mitunter zur Erhaltung der Lebensqualität des Patienten und einer guten Beweglichkeit dennoch erforderlich. Sowie ein „wearing off“ oder andere Komplikationen auftreten, ist über eine Verkürzung des Dosisintervalls nachzudenken. Zu berücksichtigen bleibt hierbei der Abstand zu Mahlzeiten und der Schwierigkeit des Patienten, mehr als eine Tabletteneinnahme am Tag zu koordinieren.
- Da das Risiko von Halluzinationen und kognitiven Störungen, aber auch anderer Nebenwirkungen, wie Müdigkeit, unter Levodopa generell am geringsten ist, ist Levodopa die bevorzugte Substanz zur Therapie des IPS bei Patienten über dem 70. Lebensjahr und mit einer Multimorbidität.
- Derzeitig sind in Deutschland Retardpräparate mit nur eingeschränkt verlässlicher Retardierung erhältlich. Diese sind in der Regel nicht sinnvoll über den Tag zu verteilen, sondern lediglich als Retardpräparat zur Nacht zu geben. Möglicherweise ist mit neuen Applikationsformen, wie neuen Retardpräparaten oder Inhalationspulver in Zukunft eine veränderte retardierte Applikation von Levodopa möglich.
- Zur schnellen Resorption von Levodopa stehen lösliche Präparate (z.B. Madopar LT) zur Verfügung. Bei einem ausgeprägten Off-Zustand in den Morgenstunden oder im Verlauf des Tages erscheint die Gabe einer löslichen Madopar-Tablette sinnvoll.
- Als neue Möglichkeit der Behandlung von OFF-Phasen ist inhalatives L-Dopa verfügbar. Hier werden zwei Hübe appliziert, die zu einer Verbesserung der OFF-Symptomatik innerhalb von 15-20 Minuten führen.
- Zur kontinuierlichen subkutanen Therapie steht Foslevodopa/Foscarbidopa zur Verfügung, das 24 Stunden pro Tag kontinuierlich über die Haut verabreicht wird und bei mit oraler Therapie nicht ausreichend behandelbaren Fluktuationen eingesetzt werden kann0 (siehe auch Levodopa-Infusionstherapie).
COMT-Hemmer
- Im Verlauf der Parkinson-Erkrankung kommt es – vermutlich durch die Degeneration von dopaminergen Terminalen – zu einer verkürzten Speicherung von Levodopa und damit einer verminderten Wirkdauer. Patienten berichten klinisch über eine „wearing off“, dem Nachlassen in der Länge der Wirkung einer Levodopa-Tablette.
- Diesem Effekt kann durch die ergänzende Gabe eines COMT-Hemmers (COMT: Catechol-O-Methyltransferase) entgegengetreten werden: Der wesentliche Effekt eines COMT-Hemmers besteht darin, die Degradation von Levodopa zu verhindern und damit mehr Levodopa an den dopaminergen Terminalen zur Verfügung zu stellen.
- Risiko bei der Eindosierung von Entacapon (200mg zu jeder Levodopa-Gabe), Tolcapon (100mg 3-mal/d) oder Opicapon (50mg ret. zur Nacht) ist die Entwicklung von Dyskinesien und/oder Hyperkinesen, sodass bei den meisten Patienten die Levodopa-Dosis reduziert werden muss (z.B. 4-mal 100mg Levodopa vor Entacapon, nach Eindosierung von Entacapon 100mg – 75mg, 75mg, 75mg). Auch auf psychotische Phänomene (durch die mögliche dopaminerge Überstimulation) ist im Rahmen der Eindosierung zu achten.
- Unter Tolcapon wurde über schwere Hepatotoxizität berichtet, sodass zunächst mit Entacapon oder Opicapon Therapieversuche unternommen werden sollten. Leberwertkontrollen unter Tolcapon schränken somit die Alltagstauglichkeit ein (Monate 1–12: Kontrolle alle 2 Wochen, Monat 13–18: alle 4 Wochen, nach 19. Monat: alle 8 Wochen).
MAO-B-Hemmer
- Eine weitere Option zur Verlängerung und Verstärkung der Levodopa-Wirkung ist die Gabe eines MAO-B-Inhibitors, z.B. Rasagilin.
- MAO-B-Hemmer verbessern ein End-of-Dose-Phänomen und haben eine milde antidepressive Wirkung; es kommt jedoch vereinzelt zu einer Verstärkung von Levodopa-induzierten Dyskinesien.
- Sinnvolle Dosierungen sind 1mg Rasagilin am Morgen oder 5mg Selegilin (Steigerung nach 1–2 Wochen auf 2-mal 5mg Selegilin/d).
- Ein recht neu in Deutschland erhältlicher MAO-B-Hemmer mit einer zusätzlichen Funktion auf das NMDA-Rezeptorsystem (NMDA: N-Methyl-D-Aspartat) ist Safinamid. Neben einer Verlängerung der On-Zeit wurden in Studien Hinweise auf eine milde antidyskinetische Wirkung in der Dosierung von 100mg/d gefunden. Empfehlenswert ist eine Eindosierung von 50mg initial und eine Steigerung bei guter Verträglichkeit auf 100mg/d. Gegebenenfalls sollte die Levodopa-Dosis (außer der Morgendosis) um ca. 25% reduziert werden (z.B. vor Safinamid: 100mg Levodopa 1 – 1 – 1 – 1, nach Eindosierung von Safinamid: 1 – ¾ – ¾ – ¾).
Amantadin
- Mit einem unterschiedlichen Wirkprinzip am NMDA-Rezeptor sind vor allem jüngere Patienten mit Amantadin gut zu behandeln. Probleme wie Halluzinationen, Verwirrtheit, Schwellung von Gelenken oder eine marmorierte Haut werden besonders bei älteren Patienten (>60 Jahre) gefunden.
- Effekte von Amantadin scheinen sich nach klinischer Erfahrung auch auf Gang und Stand positiv auszuwirken. Eine Reduktion von Dyskinesien ist möglich, neben einer milden Verbesserung der Beweglichkeit. Aufgrund einer unter Amantadin erhöhten Wachheit sollte Amantadin nicht am späteren Nachmittag oder Abend gegeben werden, in der Praxis hat sich eine Gabe am Morgen und eine weitere zur Mittagszeit bewährt.
- Eine sinnvolle initiale Dosierung sind 2-mal 100mg (morgens und mittags). Bei guter Verträglichkeit kann bis 450mg/d gesteigert werden.
- Der NMDA-Rezeptorantagonist Budipin kann zu lebensgefährlichen Herzrhythmusstörungen, vor allem bei Patienten mit QT-Zeitverlängerungen, führen und sollte nur in gut begründeten Einzelfällen eingesetzt werden.
Anticholinergika
-
Anticholinergika spielen in der Therapie des Morbus Parkinson nur noch eine geringe Rolle. Vereinzelt kann ein sehr positiver Effekt auf den Tremor oder auch dystone Fehlstellungen (z.B. eine morgendliche Off- oder On-Dystonien) erzielt werden.
-
Problematisch bei Anticholinergika sind Verwirrtheitszustände und kognitive Störungen bei vor allem älteren Patienten und – durch die anticholinerge Wirkung – Nebenwirkungen wie Harnverhalt oder die Verstärkung eines Glaukoms.
-
Bei der Therapie von dystonen Störungen ist nach Erfahrung der Autoren oft Trihexyphenidyl (z.B. Artane, initial 2mg, vorsichtige Steigerung bis maximal 3-mal 5mg/d) indiziert.
Interventionelle Therapie
Tiefe Hirnstimulation
- Insbesondere jüngere Patienten und Patienten mit einem guten Ansprechen auf Levodopa zeigen im Krankheitsverlauf ausgeprägte Fluktuationen zwischen einem dyskinetischen On-Zustand und schlechter Beweglichkeit im „Off“. Ursächlich für diese Fluktuationen ist vermutlich neben einer verminderten Speicherkapazität der dopaminergen Terminalen auch ein verändertes Wirkverhalten der Dopaminrezeptoren. Derartige Fluktuationen lassen sich mit der Tiefen Hirnstimulation im Nucleus subthalamicus oft dramatisch verbessern, Wirkprinzip ist vermutlich die Reduktion von pathologischer Aktivität in den Basalganglien-Kortex-Schleifen.
- Bei einem Teil der Parkinson-Patienten mit ausgeprägter Tremorsymptomatik ist diese nicht durch Medikamente positiv zu beeinflussen. Die Tiefe Hirnstimulation führt bei diesen Patienten mit hoher Wahrscheinlichkeit zu einer erheblichen Verbesserung des Tremors.
- Bei Patienten mit vor allem medikamenteninduzierten Impulskontrollstörungen ist eine Verbesserung dieser durch eine Tiefe Hirnstimulation mit anschließender Reduktion der Medikation möglich. Eine engmaschige präoperative Abklärung und Beratung, sowie eine perioperative Begleitung ist hier besonders wichtig.
- Die Nebenwirkungen der Tiefen Hirnstimulation liegen in operationsassoziierten Problemen durch die dauerhafte Stimulation und Problemen durch die voranschreitende Krankheitsprogression.
- Folgende Bedingungen erhöhen das Risiko für Komplikationen, Nebenwirkungen und perioperative Probleme:
- Hirnatrophie (Hirnblutung, postoperative Verwirrtheit)
- präoperative demenzielle Entwicklung (Verwirrtheit, intra- und postoperativ, geringe Compliance)
- Depression und Apathie (Risiko für postoperative depressive/apathische Störung)
- Suizidalität oder Suizidversuche in der Vergangenheit (Suizidalität)
- ausgeprägte Gangstörung/posturale Instabilität (Stürze)
- ausgeprägte Dysarthrie und Hypophonie (postoperative Sprechstörung)
- Bester Prädiktor für eine gute Wirkung der Tiefen Hirnstimulation ist ein gutes Ansprechen im Levodopa-Test. Die Patientenevaluation und Beratung sollte in einem erfahrenen Zentrum mit einem interdisziplinären Team aus Neurologen, Neurochirurgen, Psychiatern, Logopäden und Anästhesisten durchgeführt werden.
- Bei Patienten unter 61 Jahren und beginnenden Problemen im Alltag hat die EARLY-STIM-Studie gezeigt, dass eine frühere Tiefe Hirnstimulation (Zulassungskriterien der FDA: ab dem 4. Krankheitsjahr mit mindestens 4 Monaten motorischen Komplikationen) der medikamentösen Therapie überlegen ist in der Verbesserung von Lebensqualität und Beweglichkeit im Alltag.
Apomorphin-Infusionstherapie
- Apomorphin ist ein Dopaminagonist mit minimaler enteraler Resorption, aber fast 100%iger Bioverfügbarkeit bei subkutaner Applikation. Bei Patienten mit plötzlich einsetzenden Off-Phasen und bei Patienten mit erheblichen Fluktuationen über den Tag ist eine intermittierende oder auch kontinuierliche subkutane Applikation von Apomorphin eine interessante Therapieoption.
- Eine rezente europäische Multizenterstudie (Toledo-Studie) bestätigte die Ergebnisse von kleineren unkontrollierten Studien zur Effektivität dieser Therapie. In der Regel führt die Therapie zu signifikant verkürzten Off-Phasen bei erheblich verlängerten On-Phasen über den Tag. Die klinische Erfahrung bestätigt den Hinweis aus vereinzelten Studien, dass über die kontinuierliche Applikation von Apomorphin die Neigung zu Dyskinesien, z.B. auf eine definierte Dosis von Levodopa, erheblich reduziert werden kann. Insbesondere im Vergleich zur intrajejunalen Levodopa-Infusionstherapie scheint eine deutlichere Besserung von Apathie und Depression durch Apomorphin zu gelingen. Der Effekt auf die Motorik scheint hingegen etwas weniger stark ausgeprägt zu sein, als bei der Tiefen Hirnstimulation und Levodopa-Infusionstherapie.
- Nebenwirkungen der subkutanen Therapie mit Apomorphin umfassen subkutane Knötchenbildungen und Entzündungen, die durch gezieltes Training von Patienten und Pflegenden weitgehend reduziert werden können, sowie direkte pharmakologische Nebenwirkungen der Dopaminagonisten-Hochdosistherapie, z.B. akuten Blutdruckabfall, Verwirrtheitszustände, Impulskontrollstörungen und gastrointestinale Nebenwirkungen.
- Insgesamt ist die subkutane Infusionstherapie mit Apomorphin eine sehr gute Therapieoption bei eher jüngeren Patienten mit „Sudden-Offs“ (plötzliche Phasen der Unterbeweglichkeit) oder erheblichen Fluktuationen ohne relevanten Tremor, mit guter Compliance und guten kognitiven Leistungen. Die Evaluation und die Einstellung von Parkinson-Patienten auf eine Apomorphin-Therapie sollte in einem erfahrenden Zentrum erfolgen.
Levodopa-Infusionstherapie
- Parkinson-Patienten, bei denen eine orale medikamentöse Therapie zu keiner ausreichenden Linderung der Symptome führt, sind potenzielle Kandidaten für eine subkutane (SCLD) oder intrajejunale (IJLG) Applikation von Levodopa-Gel. Die SCLD-/IJLG-Infusionstherapie erfolgt in der Regel als Monotherapie und ist mit erheblichen Kosten und Logistik verbunden.
- Als weitere Variante ist die Therapie von intrajejunalem Levodopa-Carbidopa-Entacapone (LECIG) verfügbar. Die gleiche Applikation mit einem anderen Pumpensystem führt zu einer noch deutlicheren Reduktion von Wirkfluktuationen.
- Patienten mit SCLD-/IJLG-/LECIG-Infusionstherapie zeigen eine signifikante Verkürzung der Off-Zeiten bei gleichzeitiger Verlängerung der Zeiten guter Beweglichkeit ohne klinisch relevante Zunahme von Dyskinesien. Diese Veränderungen gehen mit deutlicher Verbesserung von nicht motorischen Störungen einher, die insgesamt mit der Verbesserung der Motorik zu einer deutlich verbesserten Lebensqualität führt.
- Nebenwirkungen der SCLD-Therapie sind vor allem lokal auf die Einstichstelle begrenzt, so dass eine sorgfältige Hautpflege notwendig ist.
- Nebenwirkungen der IJLG-/LECIG-Therapie resultieren aus der Notwendigkeit eine PEG-Sonde (PEG: perkutane endoskopische Gastrostomie) mit jejunalem Schenkel zu etablieren: Ein erheblicher Teil der Patienten berichtet perioperativ über Schmerzen und Probleme im Bereich der PEG-Sonde. Weitere Nebenwirkungen sind inhärent mit der Levodopa-Gabe verbunden und umfassen gastrointestinale Nebenwirkungen wie Übelkeit/Erbrechen, aber auch bei wenigen Patienten eine erhebliche Gewichtsabnahme, die Anzeichen einer Malresorption sein kann. Unklar ist momentan, ob durch hohe Mengen an Levodopa eine entzündliche/entzündlich-toxische Polyneuropathie ausgelöst und/oder verstärkt werden kann.
- Die Indikationsprüfung, Beratung des Patienten und Einstellung auf eine Levodopa-Therapie sollte in einem erfahrenen Zentrum stattfinden. Große Sorgfalt ist bei der Nachbetreuung des Patienten durch Angehörige, ambulante Pflege, Hausarzt und Spezialambulanz geboten. Prinzipiell sind die Verfahren reversibel.
Verlauf und Prognose
-
Die mittlere Überlebenszeit nach Symptombeginn bei pk-Patienten beträgt 15 Jahre, wobei es eine hohe interindividuelle Variabilität gibt.
Literatur
Quellenangaben
-
[1] Bloem BR, Okun MS, Klein C. Parkinson’s disease. Lancet 2021; 397: 2284–2303
-
[2] Kalia LV, Lang AE. Parkinson’s disease. Lancet 2015; 386: 896–912.
-
[3] Litvan I, Goldman JG, Tröster AI, Schmand BA, Weintraub D, Petersen RC, et al. Diagnostic criteria for mild cognitive impairment in Parkinson’s disease: Movement Disorder Society Task Force guidelines. Movement Disorders 2012; 27: 349–356.
-
[4] Nalls MA, Blauwendraat C, Vallerga CL, Heilbron K, Bandres-Ciga S, Chang D, et al. Identification of novel risk loci, causal insights, and heritable risk for Parkinson’s disease: a meta-analysis of genome-wide association studies. Lancet Neurol 2019; 18: 1091–1102.
-
[5] Schapira AHV, Chaudhuri KR, Jenner P. Non-motor features of Parkinson disease. Nat Rev Neurosci 2017; 18:435–450.