Parkinson-Syndrome
Radiologie
Inhaltsverzeichnis
- Steckbrief
- Synonyme
- Keywords
- Definition
- Epidemiologie
- Ätiologie und Pathogenese
- Klassifikation und Risikostratifizierung
- Symptomatik
- Methode der Wahl
- Pathognomonische Befunde
- Befundbeschreibung
- Radiologische Differenzialdiagnosen
- Typische Fehler
- Was der zuweisende Kollege/Kliniker wissen muss
- Literatur
Steckbrief
Das durch die Trias (Ruhe-)Tremor, Rigor und Akinese charakterisierte sog. idiopathische Parkinson-Syndrom wird durch einen Mangel dopaminerger Neurone verursacht, die aus der Pars compacta der Substantia nigra in das Striatum (Nucleus caudatus und Putamen) projizieren. Es gibt keine typischen MRT-Befunde, sodass das MRT angefertigt wird, um differenzialdiagnostisch vaskuläre Erkrankungen und atypische Parkinson-Syndrome wie die progressive supranukleäre Paralyse, die Multisystematrophie und die kortikobasale Degeneration auszuschließen. Letztere sind cum grano salis durch ein schlechtes Ansprechen auf L-Dopa und durch im MRT hinweisende Befunde wie z.B. eine Mittelhirnatrophie bei progressiver supranukleärer Paralyse charakterisiert.
Synonyme
- PS
- Parkinsonʼs Disease
- PD
Keywords
- Parkinson
- Morbus Parkinson
- idiopathisches Parkinson-Syndrom
- atypisches Parkinson-Syndrom
Definition
Das Parkinson-Syndrom ist die zweithäufigste neurodegenerative Erkrankung und wird klinisch durch das Vorhandensein einer Bradykinese und mindestens eines weiteren Kardinalsymptoms wie Rigor, Tremor oder Haltungsinstabilität definiert.
Epidemiologie
Häufigkeit
-
Die Inzidenz wird mit 14:100 000 Personen pro Jahr in der Allgemeinbevölkerung und mit 160:100 000 Personen pro Jahr bei den über 65-Jährigen angegeben [5].
-
Durch die Veränderung der Altersverteilung in den Industrieländern wird es vermutlich bis zum Jahr 2030 zu einer Verdopplung der Erkrankungen kommen [3].
Altersgipfel
-
Der Krankheitsbeginn liegt typischerweise zwischen dem 50. und 60. Lebensjahr.
-
Parkinson-Erkrankungen, die vor dem 40. Lebensjahr auftreten, werden als „früh beginnende“, und solche, die vor dem 21. Lebensjahr beginnen, als „juvenile Parkinson-Erkrankungen“ bezeichnet.
Geschlechtsverteilung
-
Männer und Frauen sind im Verhältnis 1,5:1 betroffen.
Prädisponierende Faktoren
-
Nur etwa 5% der Parkinson-Erkrankungen liegt eine monogene Ursache zugrunde.
-
Bei der überwiegenden Mehrheit der Erkrankungen ist ein Zusammenspiel von genetischen Faktoren [7] sowie Umwelt- bzw. Lebensstilfaktoren [9] in einem alternden Gehirn ursächlich.
Ätiologie und Pathogenese
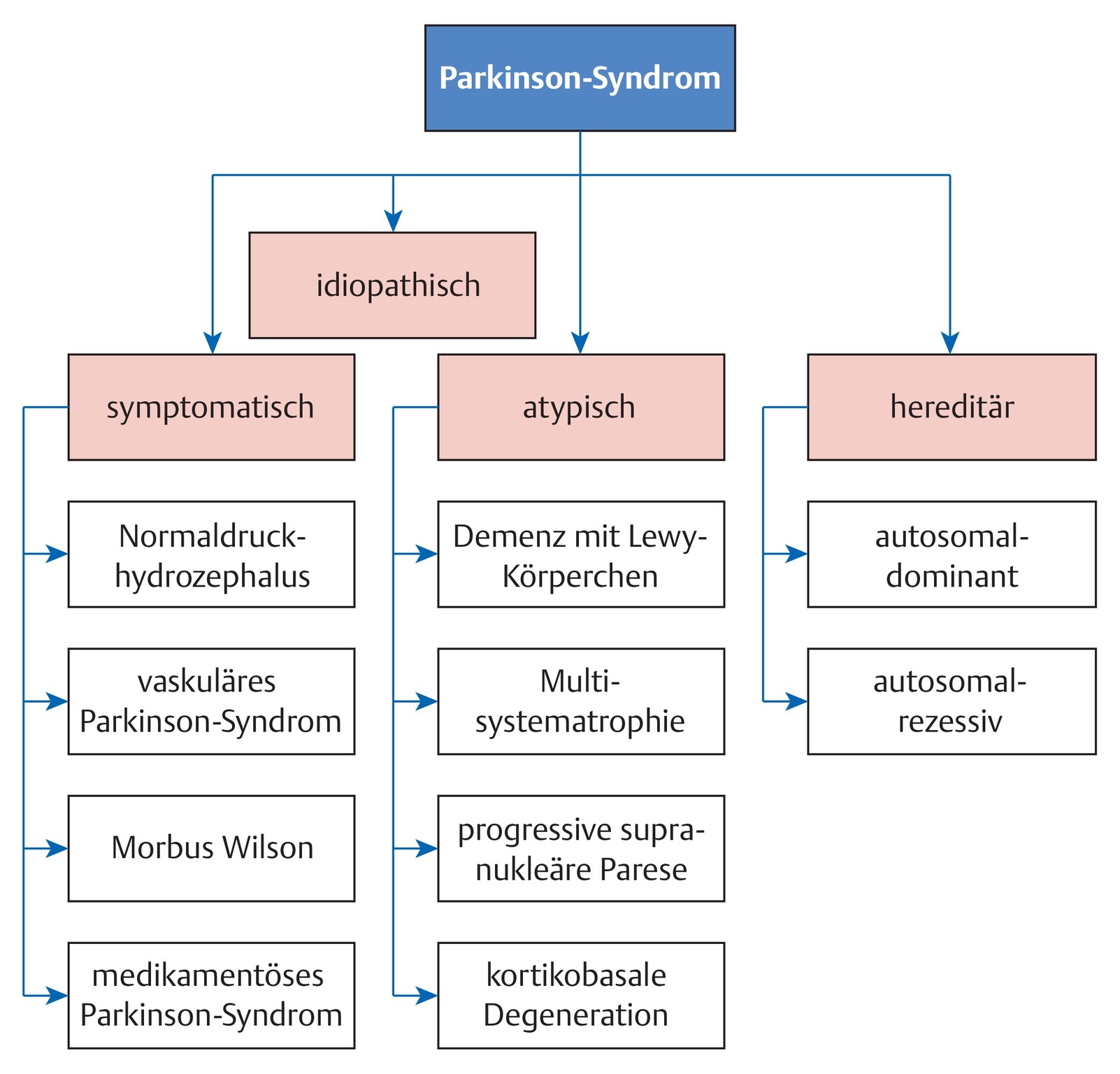
- Ätiologische Einteilung s. Abb. 69.1.
Abb. 69.1 Parkinson-Syndrome.
Ätiologische Einteilung.
Klassifikation und Risikostratifizierung
- Von der häufigsten Form, dem idiopathischen Parkinson-Syndrom, werden genetische Formen, atypische Parkinson-Syndrome und symptomatische (sekundäre) Parkinson-Syndrome abgegrenzt (s. Abb. 69.1).
Symptomatik
- Zu Beginn der motorischen Symptome können Störungen des Geruchssinns, Stimmungsschwankungen mit leichten Depressionen und eine Störung des Rapid-Eye-Movement-Schlafes vorhanden sein.
- Neben den Symptomen Ruhetremor, Rigor, Brady- oder Akinese, Gangstörung und posturale Instabilität kann im Verlauf der Erkrankung auch eine Demenz (Parkinson-Demenz) auftreten.
Methode der Wahl
- Die Diagnose idiopathisches Parkinson-Syndrom basiert auf der Anamnese und der klinischen Untersuchung.
- Wichtigstes unterstützendes Kriterium für die Diagnose in den ersten Krankheitsjahren ist ein gutes Ansprechen auf eine dopaminerge Therapie.
- Die Routinediagnostik sollte zum Ausschluss eines symptomatischen Parkinson-Syndroms eine kraniale MRT- oder, wenn das MRT kontraindiziert oder nicht verfügbar ist, eine kraniale CT-Untersuchung beinhalten.
- Im Gegensatz zur CT kann die strukturelle MRT unter Einschluss planimetrischer Verfahren zur Differenzialdiagnose neurodegenerativer Parkinson-Syndrome (atypisch bzw. idiopathisch) beitragen [2]. Es gibt 2 häufiger angewendete planimetrische Verfahren:
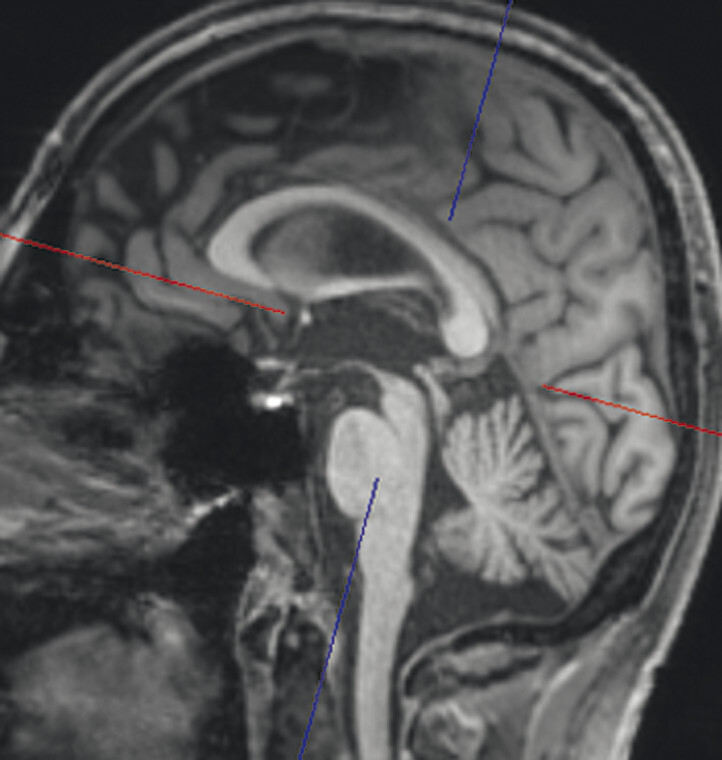
- Bei der Bestimmung der Midbrain/Pons-Ratio werden auf sagittalen Mittellinienaufnahmen Ellipsen in Pons (ohne Tegmentum pontis) und Mittelhirn gelegt und die kurzen Durchmesser der Ellipsen zueinander in Beziehung gesetzt. Bei Normalpersonen beträgt der kurze Mittelhirndurchmesser ca. ⅔ des kurzen Ponsdurchmessers, bei Patienten oder Patientinnen mit progressiver supranukleärer Blickparese ist er auf etwa 50% oder weniger erniedrigt, bei Personen mit Multisystematrophie vom zerebellären Typ auf über ⅔ erhöht [8].
- Für die Berechnung des MR-Parkinson-Indexes werden auf sagittalen Mittellinienaufnahmen Ponsfläche, Mittelhirnfläche und mittlerer Kleinhirnstieldurchmesser sowie auf koronaren T1w Aufnahmen der obere Kleinhirnstieldurchmesser bestimmt. Die Berechnung erfolgt entsprechend folgender Formel [1] [10]; ein Wert über 12,6 spricht für eine progressive supranukleäre Blickparese:
Pathognomonische Befunde
- Im Frühstadium des idiopathischen Parkinson-Syndroms sind MRT bzw. CT in der Mehrheit der Fälle unauffällig oder zeigen irrelevante Kopathologien wie z.B. milde mikroangiopathische Veränderungen.
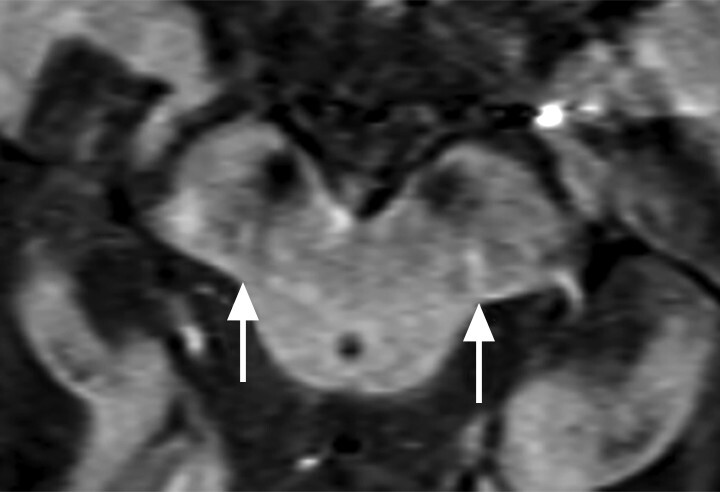
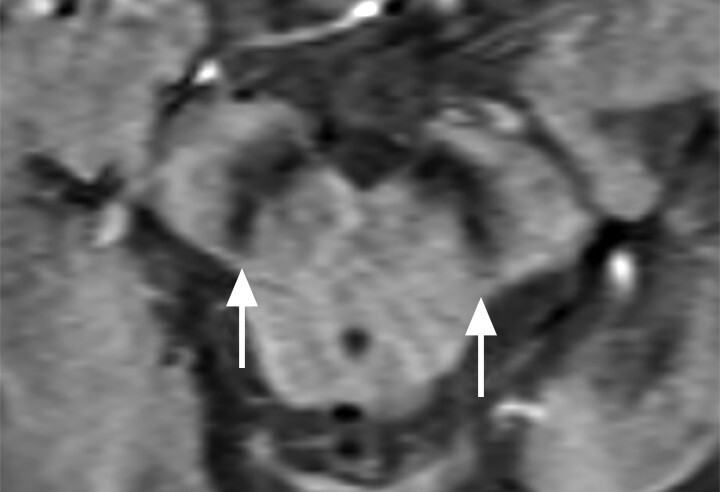
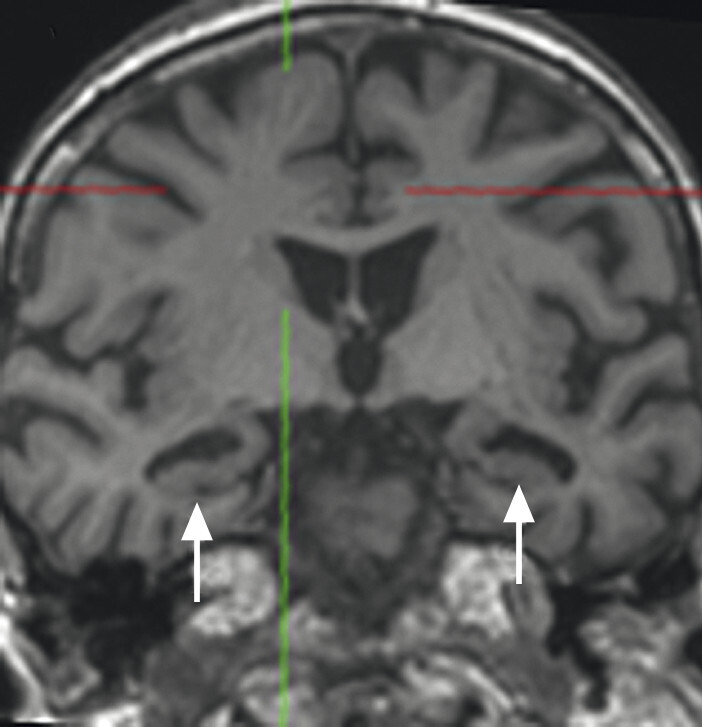
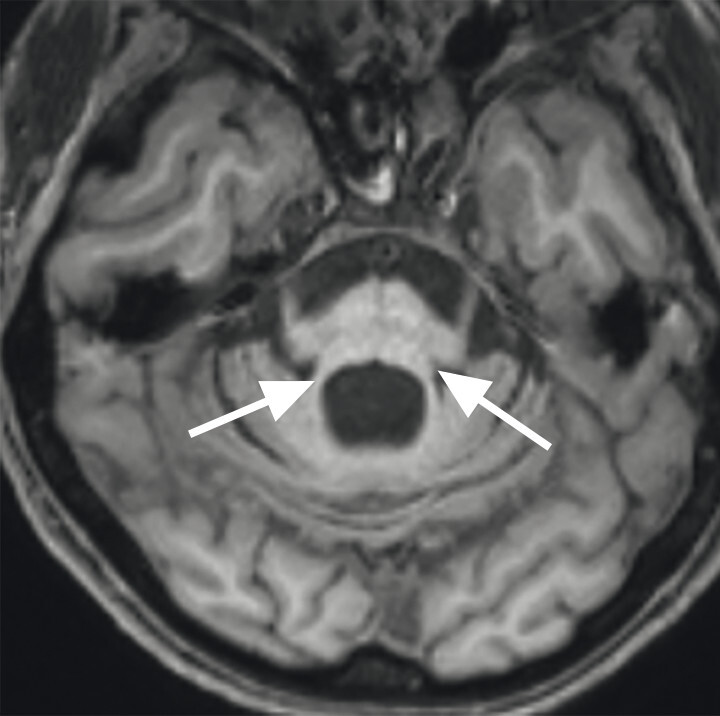
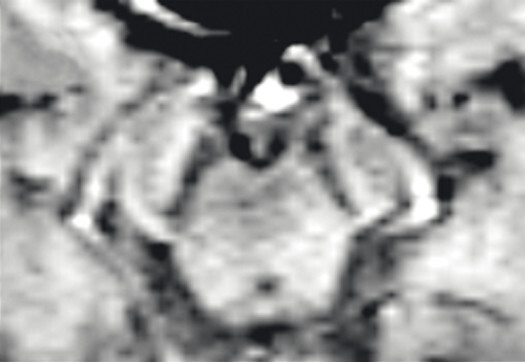
- Der Nachweis der Degeneration des dopaminproduzierenden Nigrosoms 1 innerhalb der Substantia nigra und des damit verbundenen Verlusts des Schwalbenschwanzzeichens (Swallow Tail Sign; Abb. 69.2) zeigt keinen eindeutigen Mehrwert in Bezug auf Diagnose und Differenzialdiagnose von Parkinson-Syndromen. Die Beurteilung des Schwalbenschwanzzeichens ist nämlich deutlich scanner- und befunderabhängig und wird in bis zu 50% der Fälle auch bei Patientinnen und Patienten mit frontotemporaler Demenz und Alzheimer-Demenz als anomal eingestuft [12].
- Einen diagnostischen Mehrwert in der Parkinson-Frühdiagnostik hat die FP-CIT-SPECT. Dabei wird mithilfe eines radioaktiven Markers die präsynaptische Dopamintransporterbindung dargestellt, die bei der Parkinson-Erkrankung reduziert ist. Es ist jedoch zu beachten, dass mit der FP-CIT-SPECT keine Abgrenzung von einem atypischen Parkinson-Syndrom möglich ist. Zur Differenzialdiagnose eines atypischen Parkinson-Syndroms kann die FDG-PET bzw. die Tau-PET eingesetzt werden. Mit der FDG-PET werden regionale Veränderungen des zerebralen Glukosestoffwechsels und damit krankheitsspezifische neurodegenerative Prozesse dargestellt. Die Tau-PET hilft bei der Differenzialdiagnose von Tauopathien wie z.B. der progressiven supranukleären Blickparese oder der kortikobasalen Demenz.
- Die kraniale MRT dient sowohl zur Differenzialdiagnose eines symptomatischen Parkinson-Syndroms wie z.B. der vaskulären Parkinson-Erkrankung (subkortikale vaskuläre Enzephalopathie), des Normaldruckhydrozephalus oder des Morbus Wilson als auch zur Differenzialdiagnose eines atypischen Parkinson-Syndroms durch den Nachweis eines krankheitsspezifischen Atrophiemusters.
Abb. 69.2 Parkinson-Syndrome.
a Schwalbenschwanzzeichen beidseits als Ausdruck eines unauffälligen dopaminproduzierenden Nigrosoms 1 (Pfeile).
b Beim idiopathischen Parkinson-Syndrom, aber auch bei anderen neurodegenerativen Erkrankungen, ist das Schwalbenschwanzzeichen (Swallow Tail Sign) in der SWI-MRT (Schichtdicke 2 mm) einseitig oder beidseitig nicht abgrenzbar (Pfeile).
Befundbeschreibung
Sonografie
- Die B-Bild-Sonografie bietet eine Möglichkeit, pathologische Veränderungen im Bereich der Substantia nigra darzustellen.
- Bei etwa 90% der Patienten und Patientinnen mit idiopathischem Parkinson-Syndrom zeigt sich eine Hyperechogenität innerhalb der Substantia nigra, die sich nach aktuellem Wissensstand im weiteren Verlauf der Erkrankung nicht relevant verändert. Diese Hyperechogenität der Substantia nigra stellt zwar einen sehr sensitiven, jedoch nur wenig spezifischen Krankheitsmarker dar, da bis zu 14% der gesunden Bevölkerung ebenfalls eine erhöhte Echogenität der Substantia nigra zeigen.
CT
MRT
- Bei idiopathischem Parkinson-Syndrom im frühen Stadium ist das MRT typischerweise unauffällig.
- Zum Ausschluss symptomatischer und atypischer Parkinson-Syndrome muss auf mikroangiopathische Läsionen, T2w Veränderungen in Basalganglien, Thalamus und Mittelhirn sowie krankheitsspezifische fokale Hirnvolumenminderungen geachtet werden.
- Speziell zur Beurteilung fokaler Atrophien ist die Anfertigung einer T1w 3-D-Sequenz obligatorisch. Auf Basis dieser T1w 3-D-Sequenz können zwischenzeitlich kommerziell erhältliche, automatisierte volumetrische Analyseverfahren inklusive künstlicher Intelligenzalgorithmen die Diagnose bezüglich abnormer Hirn- und Liquorvolumina unterstützen [4].
PET/PET-CT
Radiologische Differenzialdiagnosen
- Unterschiedliche symptomatische sowie atypische Parkinson-Syndrome (Tab. 69.1, Abb. 69.3, Abb. 69.4, Abb. 69.5, Abb. 69.6, Abb. 69.7, Abb. 69.8, Abb. 69.9, Abb. 69.10 und Abb. 69.11) können mithilfe einer MRT-Untersuchung von einem idiopathischen Parkinson-Syndrom unterschieden werden.
|
Differenzialdiagnose (absteigend sortiert nach klinischer Relevanz) |
Häufigkeit der Differenzialdiagnose in Hinblick auf das Krankheitsbild (häufig, gelegentlich, selten) |
wesentliche diagnostisch richtungweisende Anamnese, Untersuchung und/oder Befunde |
|
|
symptomatische Parkinson-Syndrome
|
|||
|
|
|
||
|
|||
|
|
||
|
atypische Parkinson-Syndrome
|
|||
|
|||
|
|
|
||
|
|||
|
|||
|
ARWMC = Age-related white Matter Changes Rating Scale DESH = Dysproportional enlarged subarachnoid Space Hydrocephalus FDG-PET = Fluordesoxyglukose-Positronenemissionstomografie MRT = Magnetresonanztomografie MSA-C = Multisystematrophie vom zerebellären Typ MSA-P = Multisystematrophie vom Parkinson-Typ PSP-C = zerebelläre Ataxie PSP-CBS = kortikobasales Syndrom PSP-P = progressive supranukleäre Parese mit Parkinson-Syndrom PSP-PNFA = Progressive non-fluent Aphasia PSP-RS = progressive supranukleäre Parese mit Richardson-Syndrom |
|||
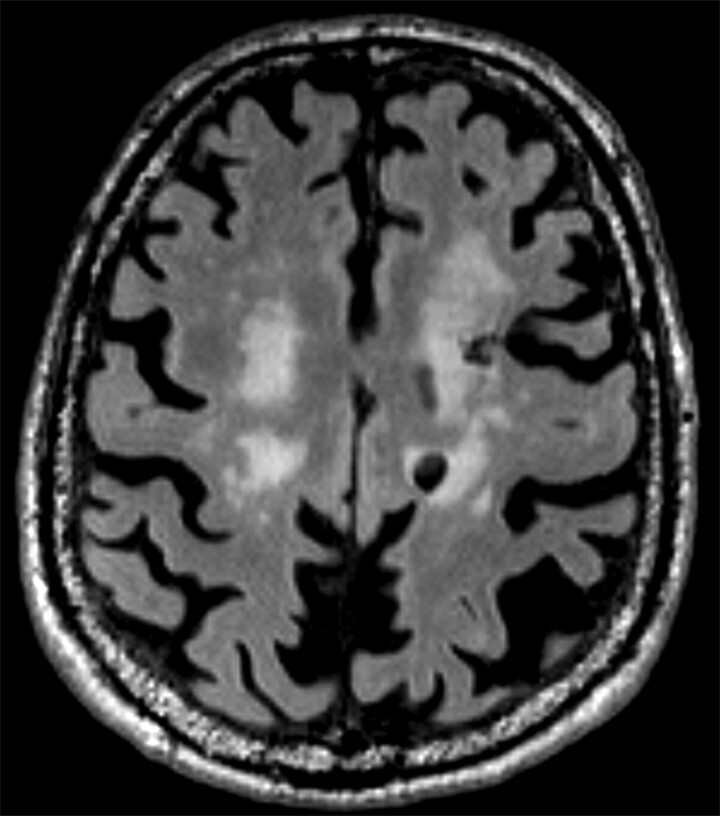
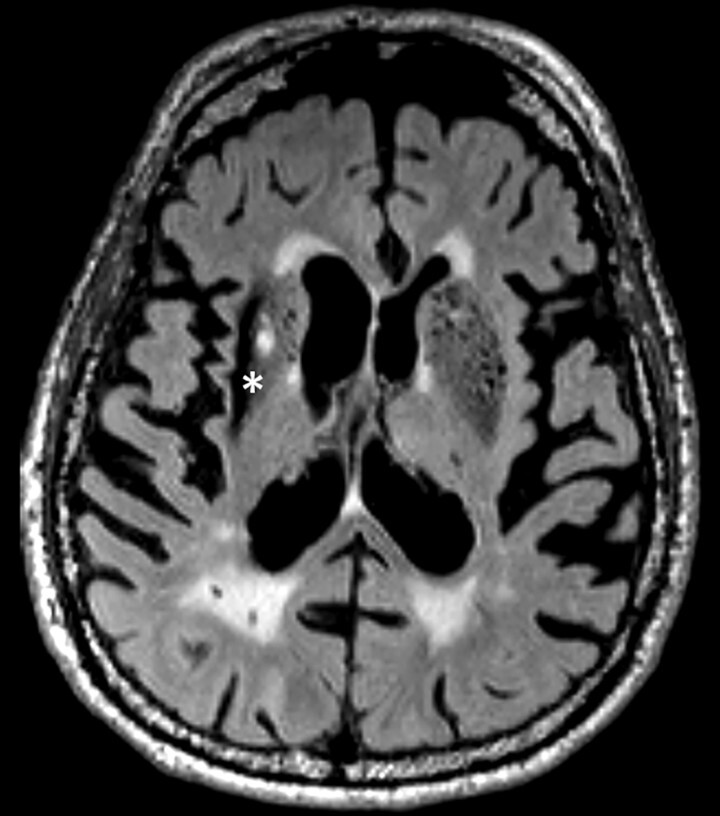
Abb. 69.3 Parkinson-Syndrome: Differenzialdiagnose subkortikale vaskuläre Enzephalopathie.
87-jähriger Mann mit Parkinson-Syndrom . ARWMC-Skala: White Matter 3 (diffus konfluierend) / Basalganglien 2 (mehr als eine fokale Läsion).
a T2w FLAIR-MRT-Sequenz. Fortgeschrittene subkortikale vaskuläre Enzephalopathie mit konfluierenden Marklagerläsionen im Centrum semiovale beidseits.
b Axiale Reformatierung einer 3-D-FLAIR-MRT-Sequenz. Zusätzliche Lakune im Putamen rechts sowie Narbe nach intrazerebraler Blutung im lateralen Putamen rechts. Der Stern kennzeichnet den strichförmigen Blutungsdefekt im Putamen.
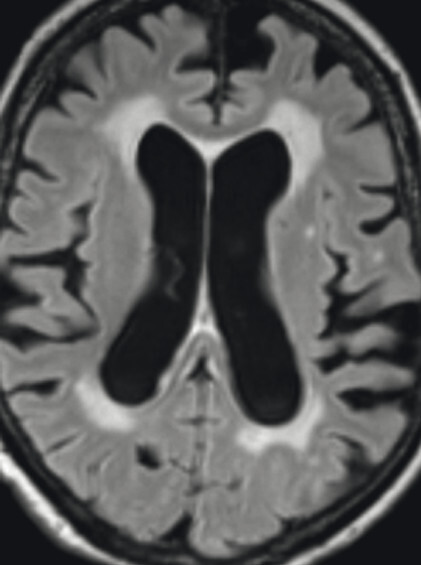
Abb. 69.4 Parkinson-Syndrome: Differenzialdiagnose Normaldruckhydrozephalus.
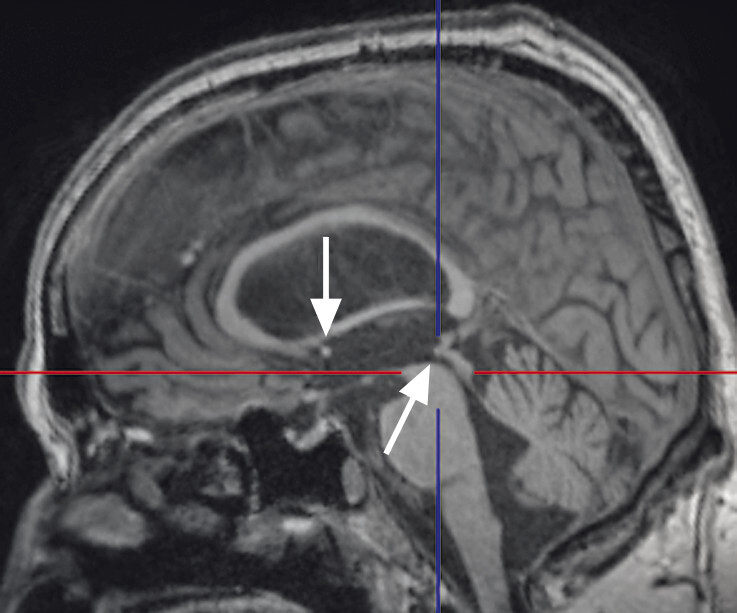
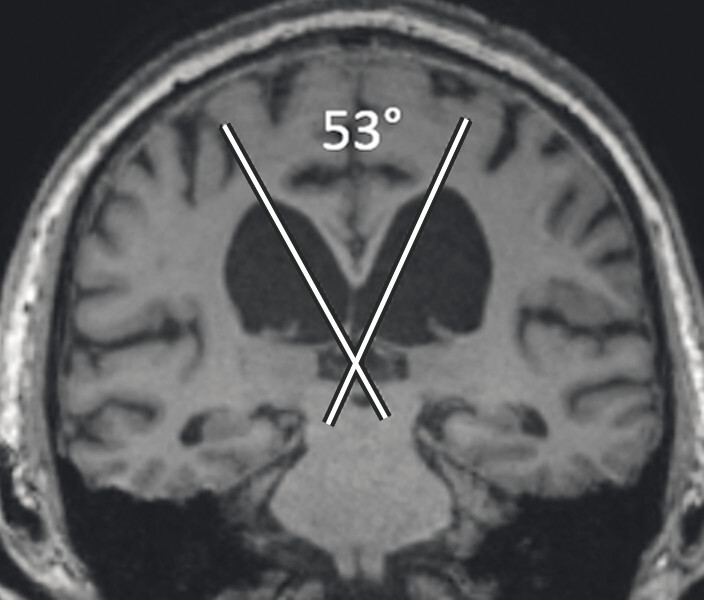
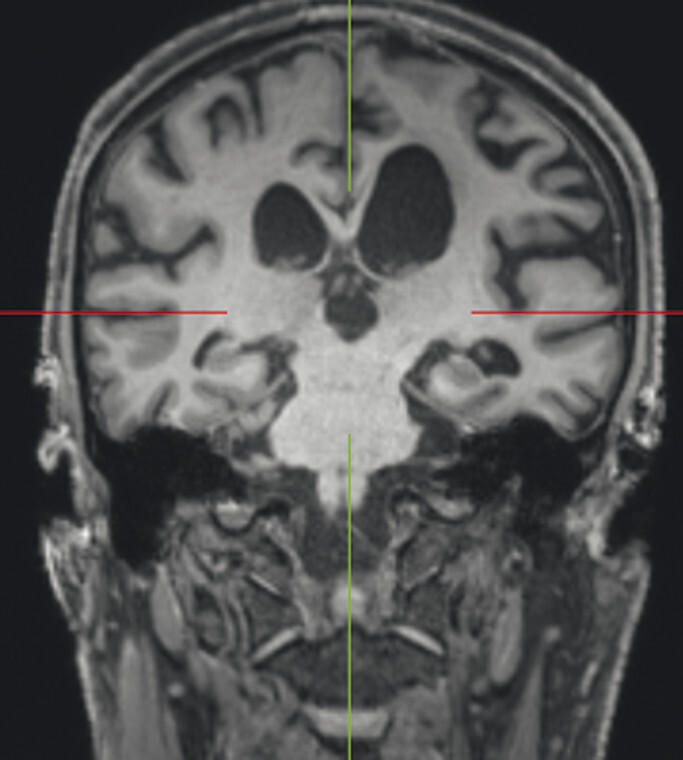
Typische Aspekte im MRT. Das DESH-Zeichen (a, Pfeile) ist am zuverlässigsten in Bezug auf das Erkennen des typischen Erscheinungsbilds eines Normaldruckhydrozephalus (a, b). Um ein weiteres typisches Zeichen, den spitzen Corpus-callosum-Winkel, verlässlich bestimmen zu können, ist es wichtig, den T1w 3-D-Datensatz exakt in der Commissura-anterior-Commissura-posterior-Linie zu orientieren (d, Pfeile) und den Winkel der Corpus-callosum-Schenkel in der koronaren Ebene auf Niveau der Commissura posterior (d, blaue Linie) zu bestimmen. Ein Corpus-callosum-Winkel von weniger als 90° gilt als anomal und als Hinweis auf den Aspekt eines Normaldruckhydrozephalus (e).
a DESH-Zeichen: disproportionale Erweiterung der inneren Liquorräume und der Sylvi-Fissur (Pfeile).
b DESH-Zeichen: enggestellte frontoparietale Liquorräume der Konvexität (s. auch a).
c Bei fortgeschrittenem Normaldruckhydrozephalus kommt es zusätzlich zu einer Liquordiapedese über die Ventrikelwände in das periventrikuläre Marklager, speziell im Bereich der Seitenventrikelvorder- und -hinterhörner (Polkappen).
d Spitzer Corpus-callosum-Winkel: Orientierung des T1w 3-D-Datensatzes exakt in der Commissura-anterior-Commissura-posterior-Linie (blaue Linie) und Bestimmung des Winkels der Corpus-callosum-Schenkel in der koronaren Ebene auf Niveau der Commissura posterior.
e Spitzer Corpus-callosum-Winkel: Beispiel eines pathologischen Corpus-callosum-Winkels.
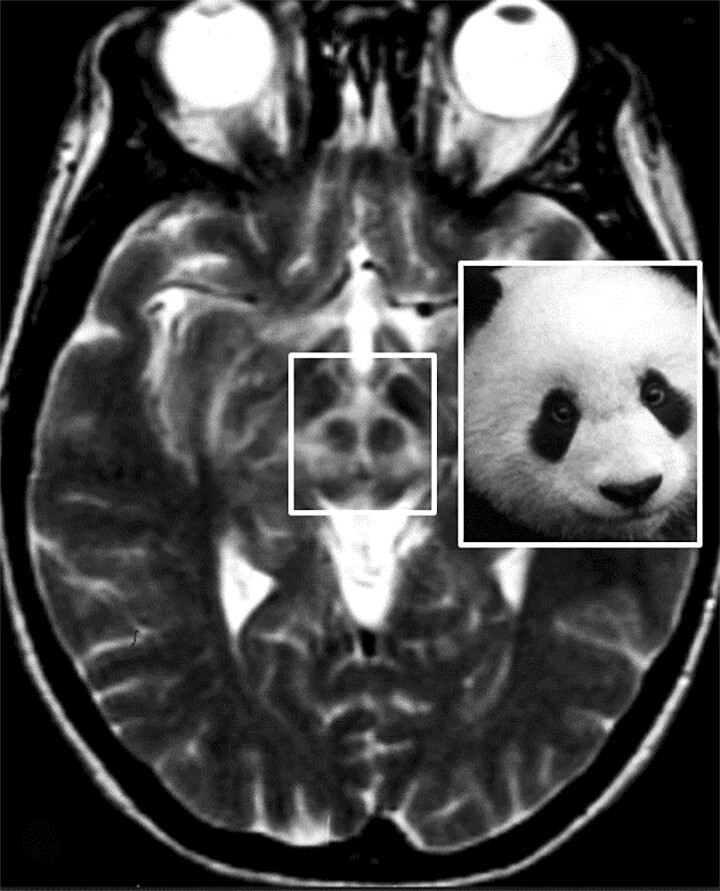
Abb. 69.5 Parkinson-Syndrome: Differenzialdiagnose Morbus Wilson.
Beim Morbus Wilson kommt es zu variabel ausgeprägten Signalveränderungen in den T2w MRT-Sequenzen im Mittelhirn um die Substantia nigra und den Nucleus ruber (Markierung: Giant Panda Sign; Pandabärzeichen).
Abb. 69.6 Parkinson-Syndrome: Differenzialdiagnose Demenz mit Lewy-Körperchen.
86-jähriger Patient mit schwerer posturaler Instabilität und Rapid-Eye-Movement-Schlafstörung. Bekannte Hyposmie, Obstipation, keine klassische hypokinetisch-rigide Klinik. Zusätzlich progressive Verschlechterung der kognitiven Fähigkeiten mit speziell visuokonstruktiven Problemen. Im MRT zeigen sich eine grenzwertige Hippokampusatrophie (a, Pfeile) und eine deutliche parietookzipitale Atrophie (b, c). Die deutliche Erweiterung der Pars marginalis des Sulcus cinguli (c, roter Pfeil), des Sulcus parietooccipitalis (c, gelber Pfeil) und des Sulcus calcarinus (c, grüner Pfeil) ist am besten auf T1w 3-D-Sequenzen in axialer und sagittaler Schichtung zu erkennen.
a Koronar reformatierte T1w MRT-Sequenz.
b Axial reformatierte T1w MRT-Sequenz.
c Sagittale T1w MRT-Sequenz.
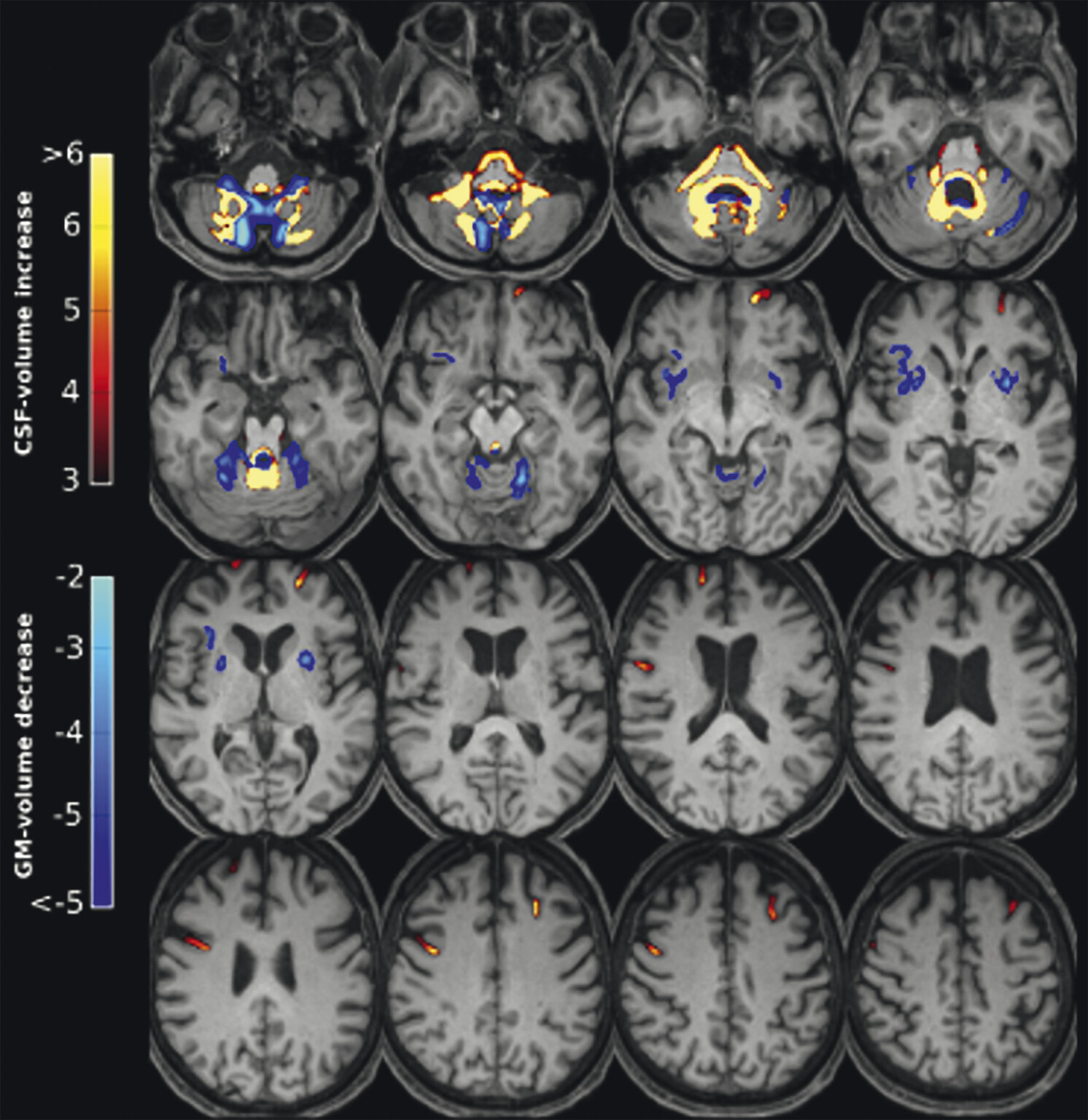
Abb. 69.7 Parkinson-Syndrome: Differenzialdiagnose Multisystematrophie vom zerebellären Prädominanztyp.
67-jährige Patientin mit über Jahre progredienter Verschlechterung des Gleichgewichts, Schluckstörungen und Sprechstörungen. In der T1w 3-D-Sequenz zeigt sich eine ausgeprägte Atrophie des Pons (a, Pfeil), der mittleren Kleinhirnstiele (b, Pfeile) und des Kleinhirns. Diese Veränderungen werden durch die Ganzhirnvolumetrie bestätigt (c): Anomale Regionen der grauen Substanz (mindestens 2 Standardabweichungen unter dem vergleichbaren Volumen des gesunden alters- und geschlechtsgematchten Normkollektivs) sind blau überlagert. Anomale Liquorvolumina (mindestens 2 Standardabweichungen über dem vergleichbaren Volumen des gesunden alters- und geschlechtsgematchten Normkollektivs) sind als rote bis gelbe Überlagerungen auf das individuelle Patientengehirn projiziert. MRT-morphologisch lässt sich somit die Verdachtsdiagnose Multisystematrophie vom zerebellären Prädominanztyp bestätigen.
a Sagittale T1w 3-D-MRT-Sequenz.
b Axiale T1w 3-D-MRT-Sequenz.
c Voxel- und regionenbasierte Analyse.
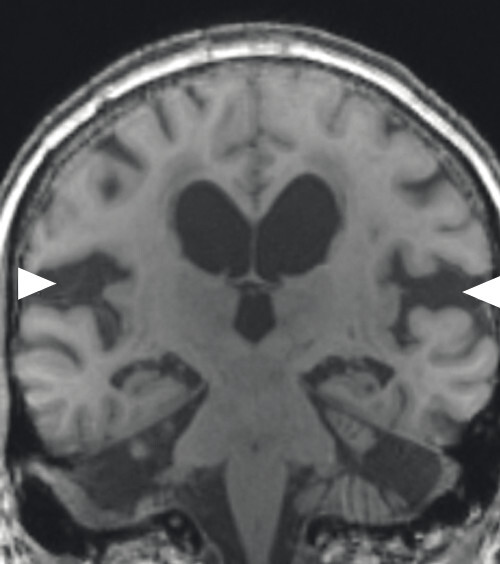
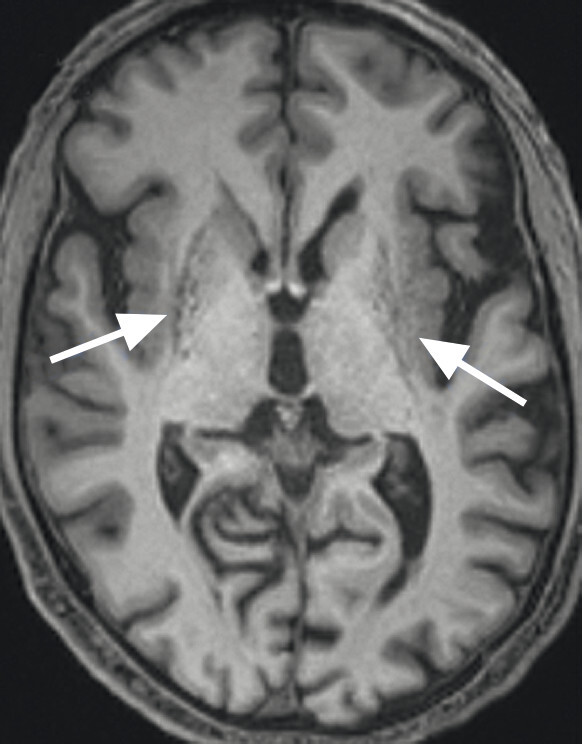
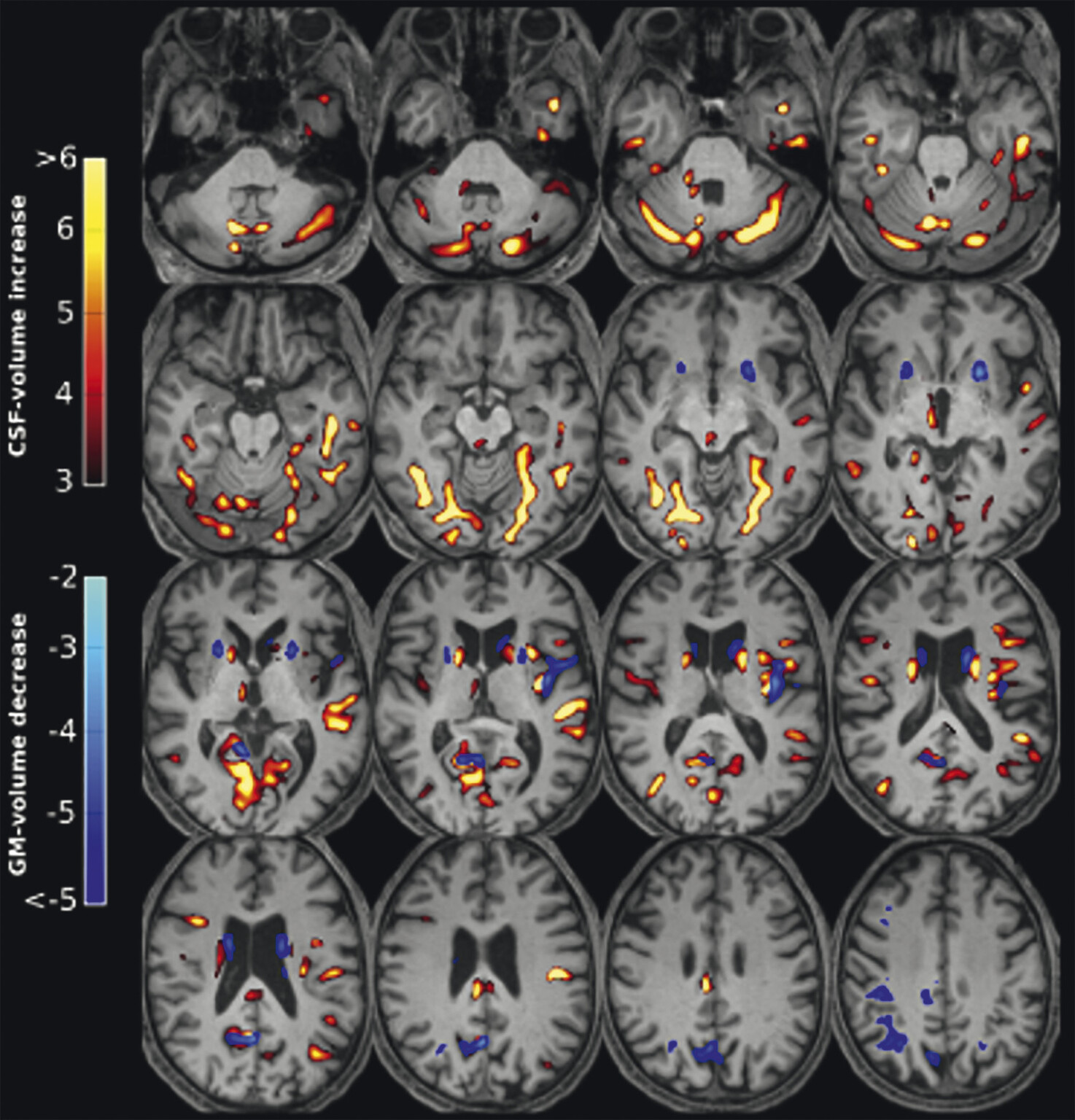
Abb. 69.8 Parkinson-Syndrome: Differenzialdiagnose Multisystematrophie vom Parkinson-Prädominanztyp.
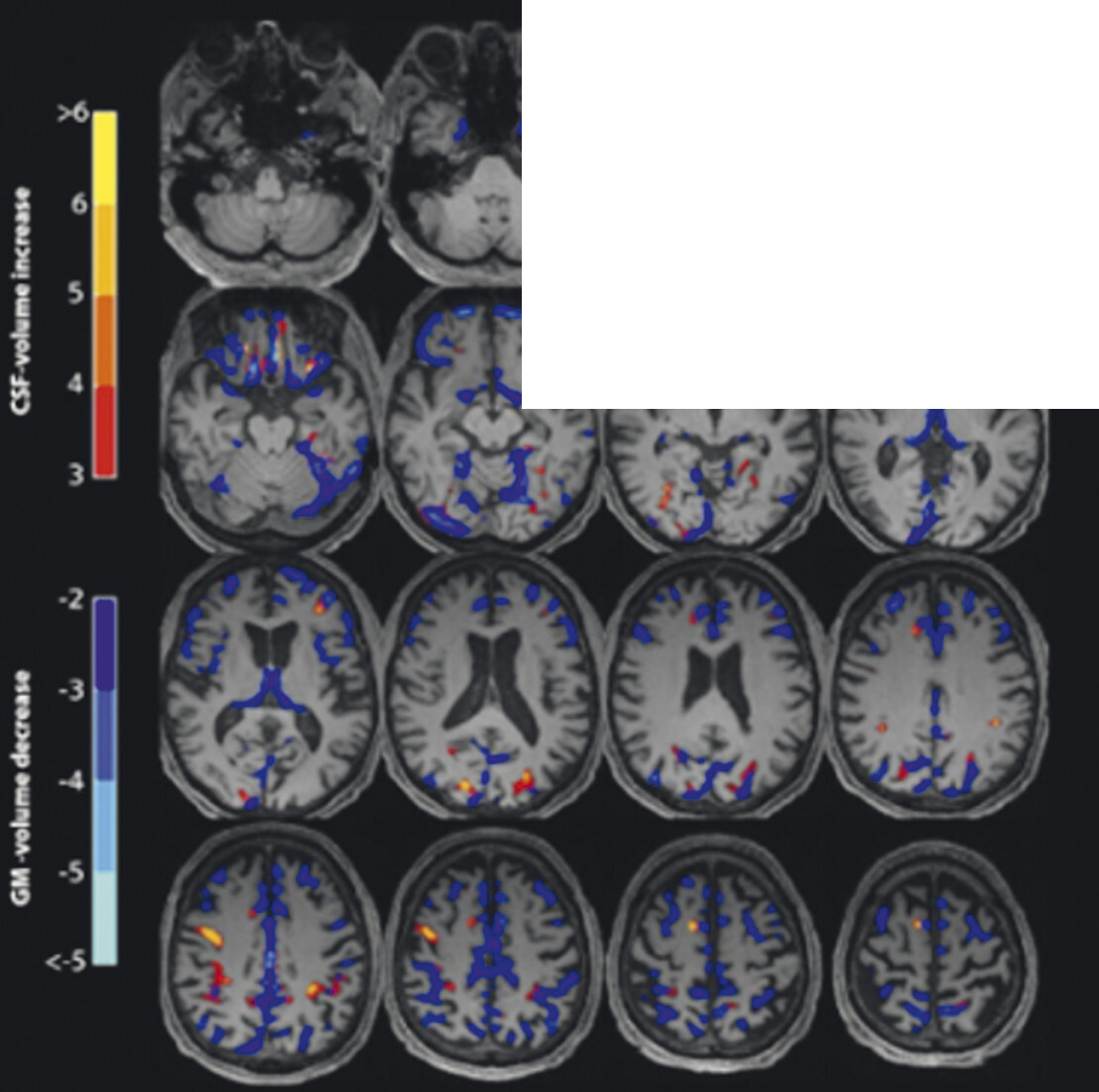
55-jähriger Patient mit vor 13 Jahren diagnostiziertem, rechtsbetontem idiopathischem Parkinson-Syndrom vom hypokinetisch-rigiden Typ. Überweisung zur Indikationsstellung für eine tiefe Hirnstimulation. Hauptprobleme sind Stürze (ca. 20 in den letzten 6 Monaten) und eine ausgeprägte Dysarthrophonie. Keine psychiatrischen Auffälligkeiten. Demenzielle Entwicklung seit ca. einem Jahr. In der T1w 3-D-Sequenz zeigt sich eine ausgeprägte Putamenatrophie beidseits (a, Pfeile). Visuell ist vor allem der Sulcus parietooccipitalis erweitert (b, Pfeil). In der Ganzhirnvolumetrie sind eine darüber hinausgehende parietookzipitale und eine zerebelläre, jedoch keine Ponsatrophie zu erkennen (c). Klinisch und MRT-morphologisch handelt es sich also nicht um ein idiopathisches Parkinson-Syndrom, sondern um eine Multisystematrophie vom Parkinson-Prädominanztyp.
a Sagittale T1w 3-D-MRT-Sequenz.
b Axiale T1w 3-D-MRT-Sequenz.
c Voxel- und regionenbasierte Analyse.
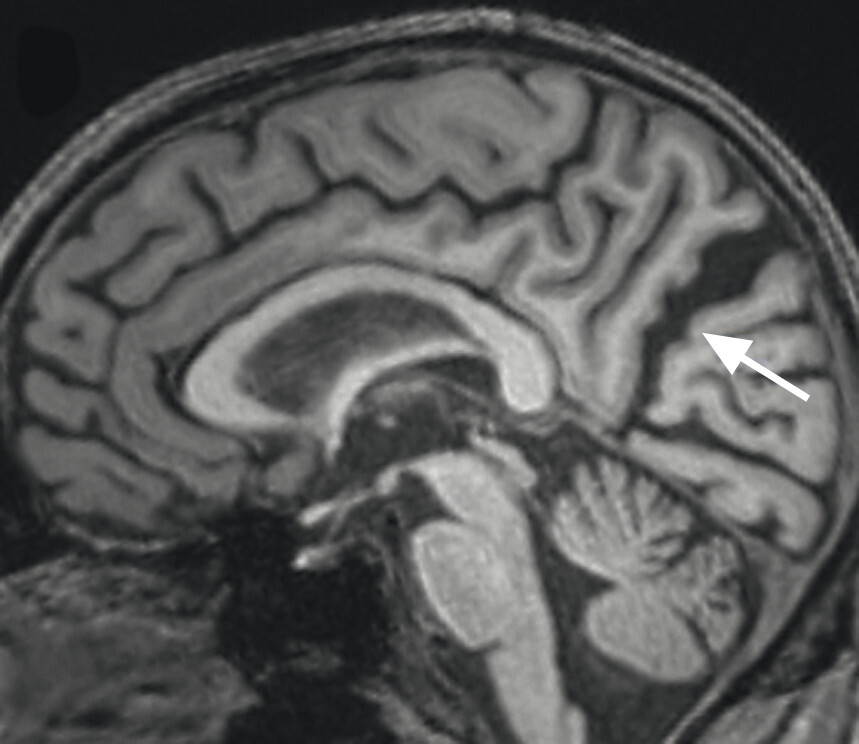
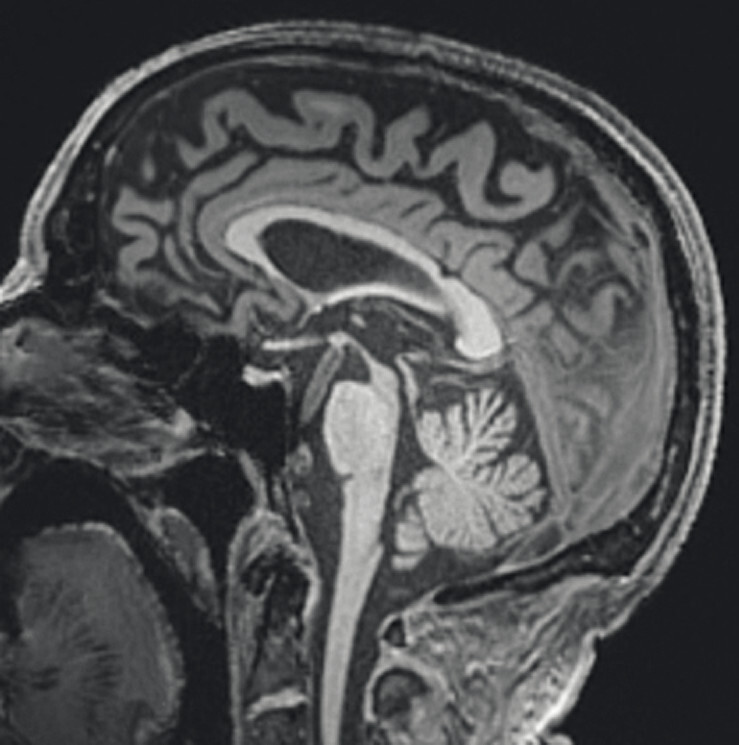
Abb. 69.9 Parkinson-Syndrome: Differenzialdiagnose progressive supranukleäre Parese mit Richardson-Syndrom.
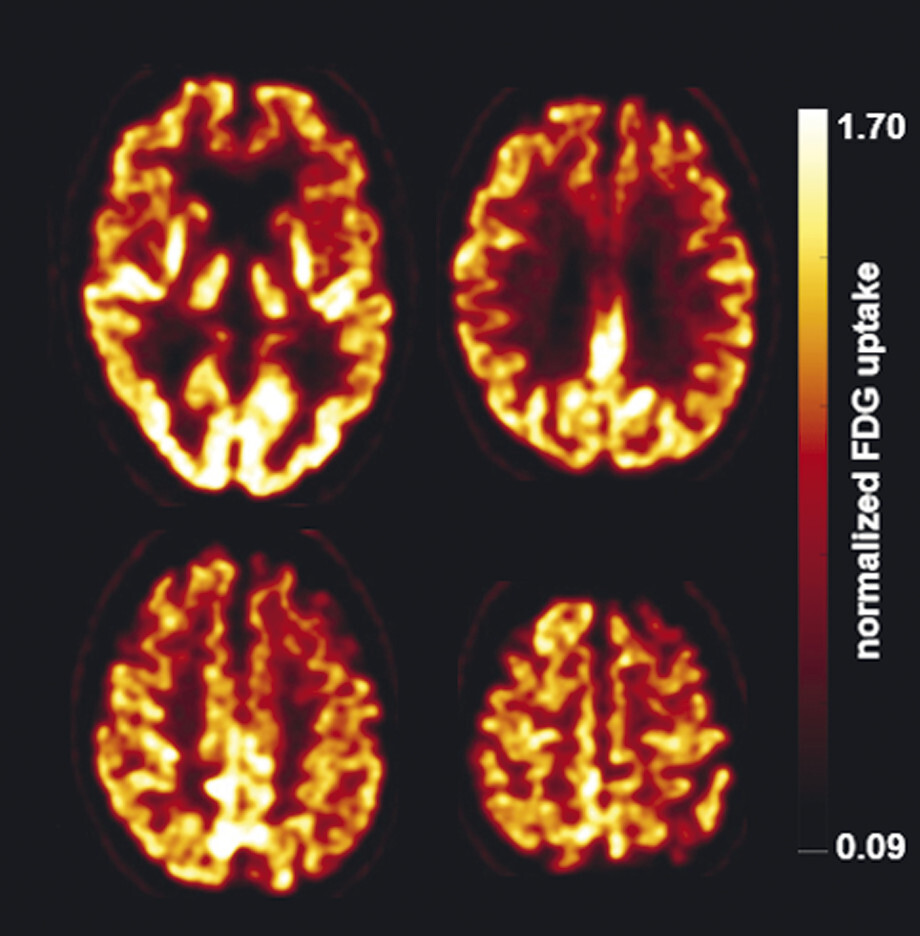
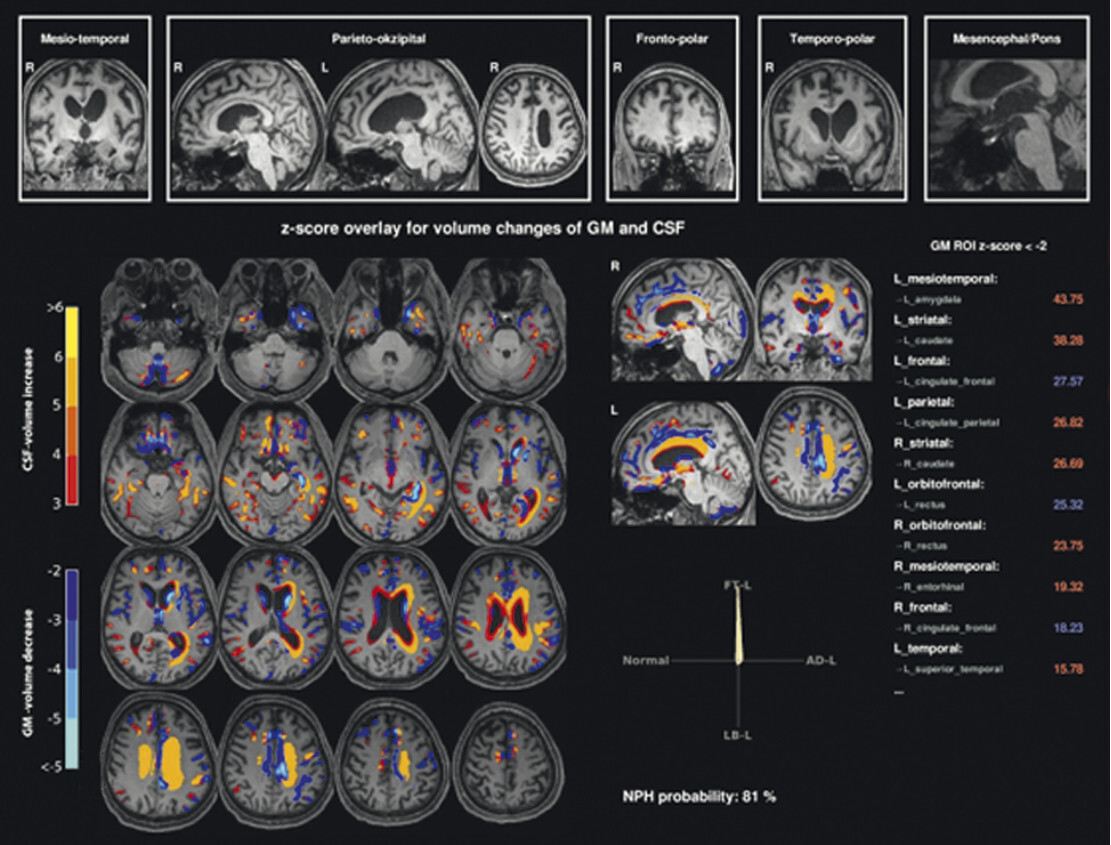
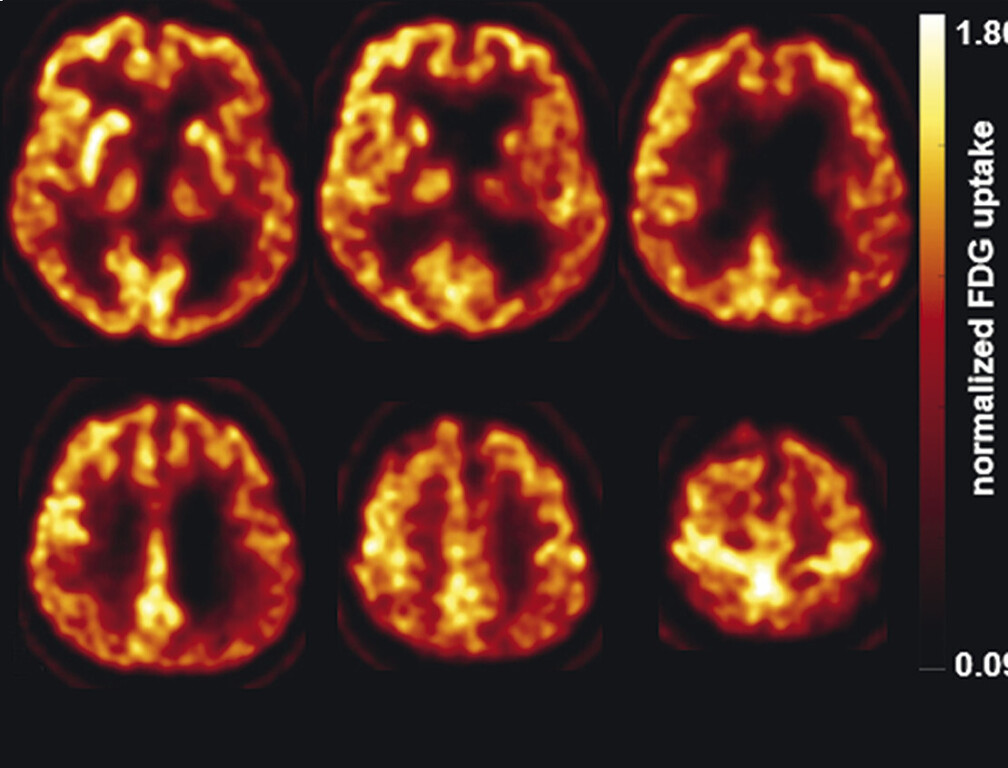
62-jähriger Mann mit über 3 Jahre zunehmender Bewegungsverlangsamung und unsicherem Gangbild. Die MP-RAGE-Aufnahmen zeigen eine deutliche Mittelhirnatrophie mit Kolibri- (a) und Mickey-Mouse-Zeichen (b). Das Mittelhirn/Pons-Verhältnis liegt mit 0,15 im pathologischen Bereich (Normalwert ca. 0,24). Die voxel- und regionenbasierte morphometrische Analyse (c) zeigt neben der Mittelhirnatrophie eine links-frontomesial betonte Atrophie, das FDG-PET (e) einen Hypometabolismus dieser Regionen. Dieses Muster ist typisch für eine sog. Tauopathie und unterstützt daher die Diagnose progressive supranukleäre Parese mit Richardson-Syndrom.
a Sagittale MP-RAGE-MRT-Sequenz.
b Axial reformatierte MP-RAGE-MRT-Sequenz.
c Planimetrische Messungen zur Bestimmung des MR-Parkinson-Index.
d Voxel- und regionenbasierte Analyse.
e FDG-PET. (mit freundlicher Genehmigung von Prof. Dr. Dr. P.T. Meyer, Klinik für Nuklearmedizin Uniklinik Freiburg)
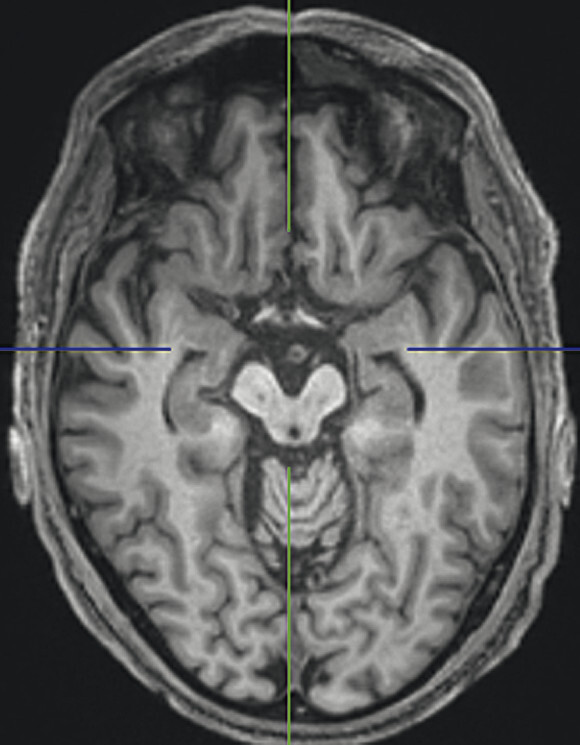
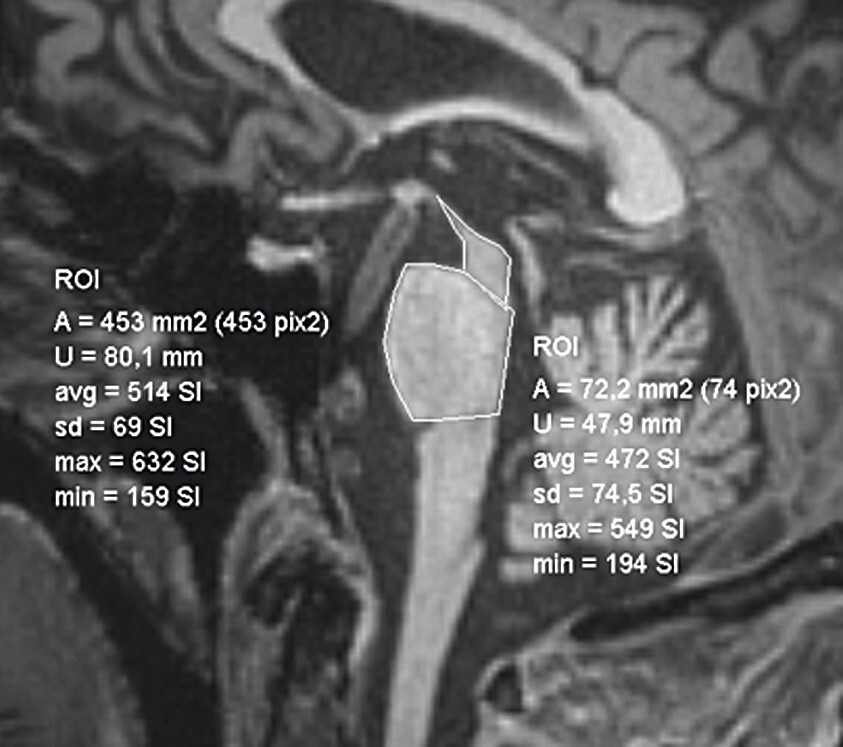
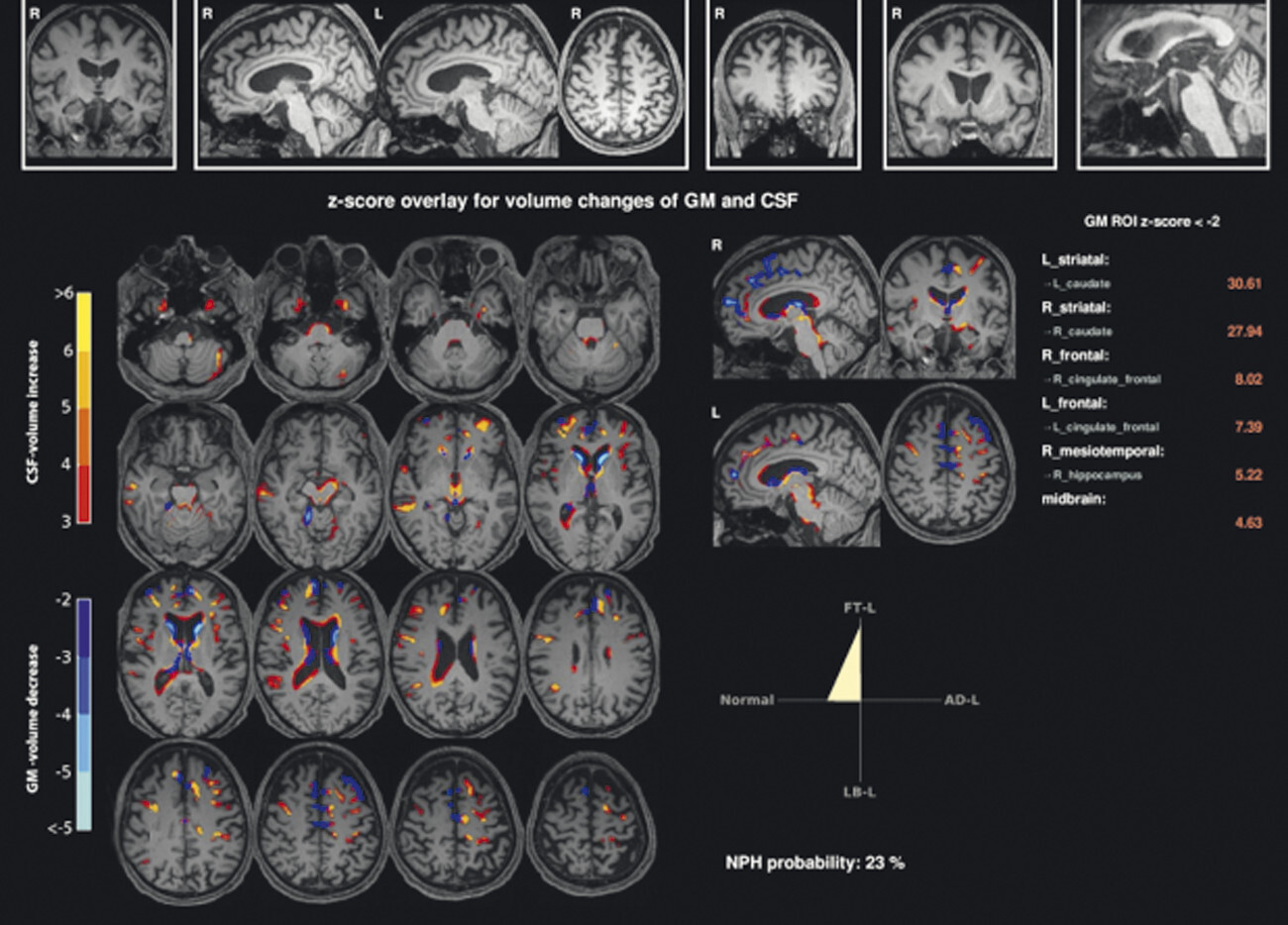
Abb. 69.10 Parkinson-Syndrome: Differenzialdiagnose progressive supranukleäre Parese mit Parkinson-Syndrom.
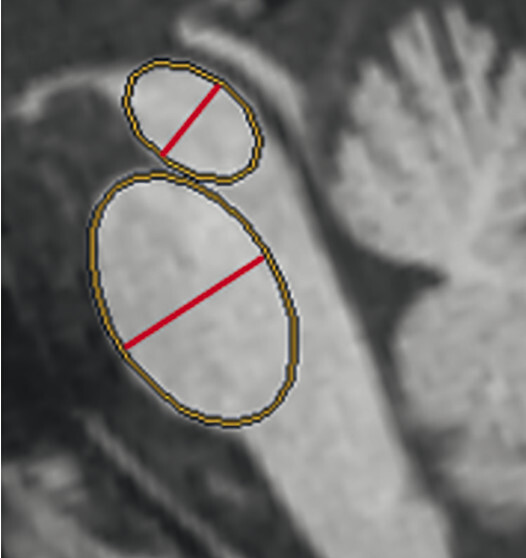
74-jähriger Patient mit linksbetontem Parkinson-Syndrom und aktuell deutlicher demenzieller Entwicklung mit exekutiver Störung und Zeitgitterstörung. In der T1w 3-D-MRT zeigt sich ein unauffälliges Mesenzephalon (a) mit einer normalen Midbrain/Pons-Ratio von 0,61 (kurzer Durchmesser des Mesenzephalons: 9,9 mm; kurzer Durchmesser des Pons: 16,1 mm, beide durch eine rote Linie dargestellt; b). Die automatisierte Ganzhirnvolumetrie (c) lässt außerdem ein anomales Hirnvolumen frontal bis parietal beidseits erkennen. In der 2 mm dünnen transversalen SWI-Schicht findet sich kein Schwalbenschwanzzeichen (d).
a T1w 3-D-MRT-Sequenz.
b T1w 3-D-MRT-Sequenz mit eingezeichneten Durchmessern.
c Ganzhirnvolumetrie.
d Transversale SWI.
Abb. 69.11 Parkinson-Syndrome: Differenzialdiagnose kortikobasale Degeneration.
61-jähriger Mann mit rechtsbetonter Gliedmaßenapraxie, sodass Schreiben und Zeichnen nicht mehr möglich sind. MP-RAGE-Aufnahmen (a–c) zeigen eine deutliche Atrophie der linken Großhirnhemisphäre mit Ausziehung vor allem der Cella media des linken Seitenventrikels. Die voxel- und regionenbasierte morphometrische Analyse (d) bestätigt die Atrophie mit Betonung des Parietallappens. Die FDG-PET (e) zeigt einen Hypometabolismus der linken Hemisphäre mit Beteiligung von Thalamus und Basalganglien. Klinische Symptomatik und Bildgebung sind passend für eine kortikobasale Degeneration.
a Sagittale MP-RAGE-MRT-Sequenz.
b Axial reformatierte MP-RAGE-MRT-Sequenz.
c Koronar reformatierte MP-RAGE-MRT-Sequenz.
d Voxel- und regionenbasierte morphometrische Analyse.
e FDG-PET. (mit freundlicher Genehmigung von Prof. Dr. Dr. P.T. Meyer, Klinik für Nuklearmedizin Uniklinik Freiburg)
Typische Fehler
- Übersehen des Aspekts eines Normaldruckhydrozephalus als Hinweis auf das Vorliegen eines symptomatischen Parkinson-Syndroms
- Übersehen einer fokalen Atrophie als Hinweis auf das Vorliegen eines atypischen Parkinson-Syndroms
Was der zuweisende Kollege/Kliniker wissen muss
-
Können relevante Differenzialdiagnosen ausgeschlossen werden, z.B. symptomatische oder atypische Parkinson-Syndrome? Ein unauffälliges MRT ist mit einem idiopathischen Parkinson-Syndrom vereinbar.
Literatur
Quellenangaben
-
[1] Constantinides VC, Paraskevas GP, Velonakis G et al. MRI Planimetry and Magnetic Resonance Parkinsonism Index in the differential diagnosis of patients with Parkinsonism. AJNR Am J Neuroradiol 2018; 39 (6): 1047–1051. doi:10.3174/ajnr.A5618
Suche in: PubMed Google Scholar -
[2] Deutsche Gesellschaft für Neurologie (DGN). S3-Leitlinie „Idiopathisches Parkinson-Syndrom“, 2016 (abgelaufen; wird zurzeit überarbeitet). AWMF Register-Nr. 030–010. Im Internet: https://www.awmf.org/uploads/tx_szleitlinien/030–010k_S3_Parkinson_Syndrome_Idiopathisch_2016–06-abgelaufen.pdf (Stand: 20.05.2021)
-
[3] Dorsey ER, Constantinescu R, Thompson JP et al. Projected number of people with Parkinson disease in the most populous nations, 2005 through 2030. Neurology 2007; 68 (5): 384–386
Suche in: PubMed Google Scholar -
[4] Gunter NB, Schwarz CG, Graff-Radford J et al. Automated detection of imaging features of disproportionately enlarged subarachnoid space hydrocephalus using machine learning methods. Neuroimage Clin 2019; 21: 101605. doi:10.1016/j.nicl.2018.11.015
Suche in: PubMed Google Scholar -
[5] HirtzD. How common are the „common“ neurologic disorders? Neurology 2007; 68 (5): 326–337
Suche in: PubMed Google Scholar -
[6] Hoglinger GU, Respondek G, Stamelou M et al. Clinical diagnostic criteria for progressive supranuclear palsy of the Movement Disorder Society. Mov Disord 2017; 32 (7): 995–1005
Suche in: PubMed Google Scholar -
[7] Lill CM, Roehr JT, McQueen MB et al. Comprehensive research synopsis and systematic meta-analyses in Parkinsonʼs disease genetics: the PDGenedatabase. PLOS Genet 2012; 8 (3): e1002548
Suche in: PubMed Google Scholar -
[8] Massey LA, Jäger HR, Paviour DC et al. The midbrain to pons ratio: a simple and specific MRI sign of progressive supranuclear palsy. Neurology 2013; 80: 1856–1861
Suche in: PubMed Google Scholar
[9] Noyce AJ, Bestwick JP, Silveira-Moriyama L et al. Metaanalysis of early non motorfeatures and risk factors for Parkinson disease. Ann Neurol 2012; 72 (6): 893–901
Suche in: PubMed Google Scholar -
[10] Quattrone A, Nicoletti G, Messina D et al .MR imaging index for differentiation of progressive supranuclear palsy from Parkinson disease and the Parkinson variant of multiple system atrophy. Radiology 2008; 246 (1): 214–221
Suche in: PubMed Google Scholar -
[11] Sakurai K, Tokumaru AM, Shimoji K et al., Beyond the midbrain atrophy: wide spectrum of strucutral MRI finding in cases of pathologically proven PSP. Neuroradiology 2017; 59: 431–443
Suche in: PubMed Google Scholar -
[12] Shams S, Fällmar D, Schwarz S et al. MRI of the Swallow Tail Sign: a useful marker in the diagnosis of Lewy Body Dementia? Am J Neuroradiol 2017; 38 (9): 1737–1741
Suche in: PubMed Google Scholar -
[13] Wahlund LO, Barkhof F, Fazekas F et al. A new rating scale for age-related white matter changes applicable to MRI and CT. Stroke 2001; 32 (6): 1318–1322. doi:10.1161/01.str.32.6.1318
Suche in: PubMed Google Scholar -
[14] Watson R, Colloby SJ, Blamire AM et al. Assessment of regional gray matter loss in dementia with Lewy bodies: a surface-based MRI analysis. Am J Geriatr Psychiatry 2015; 23 (1): 38–46
Suche in: PubMed Google Scholar